题目内容
在标准状况下,将1.12L由X、Y组成的混合气体用水全部吸收得到1L溶液,测得溶液的pH=1,则X、Y及其体积比可能是( )
| A、H2,Cl2; 1:1 |
| B、NO2,O2;4:1 |
| C、HCl,HBr;1:1 |
| D、Cl2,SO2;1:1 |
考点:pH的简单计算
专题:电离平衡与溶液的pH专题
分析:利用代入法,就各选项根据方程式计算是否完全被吸收,并根据溶液的pH=1可知,形成的溶液氢离子浓度为0.1mol/L,据此判断.
解答:
解:A、H2,Cl2的混合气体,用水吸收,氢气不能被吸收,混合气体不能全部吸收,故A错误;
B、NO2与O2按4:1混合,发生反应4NO2+O2+2H2O=4HNO3,气体全部被吸收,1.12L标准状况下该混合气体的物质的量为0.05mol,所以NO2与O2分别为0.04mol、0.01mol,由方程式可知生成HNO30.04mol,所以溶液中c(H+)=0.04mol/L,不是0.1mol/L,故B错误;
C、1.12L标准状况下该混合气体的物质的量为0.05mol,HCl、HBr物质的量分别为:0.025mol、0.025mol,c(H+)=
=0.05mol/L,故C错误;
D、Cl2与SO2按1:1混合,发生反应Cl2+SO2+2H2O=2HCl+H2SO4,气体全部被吸收,1.12L标准状况下该混合气体的物质的量为0.05mol,所以Cl2与SO2分别为0.025mol、0.025mol,由方程式可知生成HCl0.05mol,生成H2SO40.025mol,所以溶液中c(H+)=
=0.1mol/L,故D正确;
故选:D.
B、NO2与O2按4:1混合,发生反应4NO2+O2+2H2O=4HNO3,气体全部被吸收,1.12L标准状况下该混合气体的物质的量为0.05mol,所以NO2与O2分别为0.04mol、0.01mol,由方程式可知生成HNO30.04mol,所以溶液中c(H+)=0.04mol/L,不是0.1mol/L,故B错误;
C、1.12L标准状况下该混合气体的物质的量为0.05mol,HCl、HBr物质的量分别为:0.025mol、0.025mol,c(H+)=
| 0.05mol |
| 1L |
D、Cl2与SO2按1:1混合,发生反应Cl2+SO2+2H2O=2HCl+H2SO4,气体全部被吸收,1.12L标准状况下该混合气体的物质的量为0.05mol,所以Cl2与SO2分别为0.025mol、0.025mol,由方程式可知生成HCl0.05mol,生成H2SO40.025mol,所以溶液中c(H+)=
| 0.05mol+0.025mol×2 |
| 1L |
故选:D.
点评:考查根据方程式的计算、溶液pH值计算,难度中等,关键是对方程式的掌握.

练习册系列答案
相关题目
下列判断中错误的是( )
| A、0.1 mol/L的某碱液其pH小于13而大于7,此碱为弱碱 |
| B、pH=1的某酸稀释10倍后,1<pH<2,此酸为弱酸 |
| C、pH=13的某碱稀释10倍后,12<pH<13,此碱为弱碱 |
| D、0.1 mol/L的某酸,被NaOH中和至pH=7时,所反应的NaOH物质的量大于该酸物质的量,则此酸为弱酸 |
化学与生活、社会密切相关.下列说法正确的是( )
| A、硫在过量的氧气中燃烧生成三氧化硫 |
| B、氢氧燃料电池、铅蓄电池、硅太阳能电池中都利用了原电池原理 |
| C、氨气溶于水显碱性,可以用湿润的红色石蕊试纸检验氨气的生成 |
| D、Mg可由电解熔融的MgCl2制取,Al也可由电解熔融AlCl3制取 |
下列有机物发生的反应属于加成反应的是( )
| A、乙烯使KMnO4溶液褪色 |
| B、乙烯使溴的四氯化碳溶液褪色 |
| C、甲烷和氯气混合,见光 |
| D、用乙醇、乙酸与浓H2SO4混合加热 |
向三份0.lmol/L NaHCO3溶液中分别加入少量冰醋酸、Ca(OH)2、NaA1O2固体(忽略溶液体积变化),则溶液中CO32-浓度的变化依次为( )
| A、减小、减小、增大 |
| B、减小、增大、增大 |
| C、增大、减小、减小 |
| D、减小、减小、减小 |
由地壳中含量第一、第二的两种元素形成的化合物,不具有的性质是( )
| A、高温下可与生石灰发生化合反应 |
| B、熔点高 |
| C、与水作用生成相应的酸 |
| D、与碳共热可发生置换反应 |
反应2A(g)?2B(g)+E(g)(正反应为吸热反应)达到平衡时,要使正反应速率降低,A的浓度增大,应采取的措施是( )
| A、加压 | B、减压 |
| C、减少E的浓度 | D、降温 |
阿伏加德罗常数约为6.02×1023mol-1,下列说法中正确的是( )
| A、2.4g 镁作还原剂时失去电子数是0.1×6.02×1023 |
| B、标准状况下,22.4L 氮气中含有的共价键数是6.02×1023 |
| C、标准状况下,5.6 L的甲醛所含的电子数是4×6.02×1023 |
| D、100mL 1mol/L氨水溶液中,铵根离子的个数0.1×6.02×1023 |
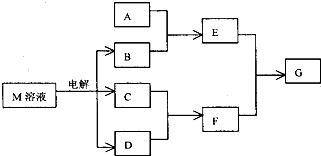 已知M是由X、Y两种位于同周期的元素组成的离子化合物,且X+与氖原子具有相同的电子层结构,Y元素的最高正价与它的负价代数和为6.M与相关物质的转化关系如图(部分产物已略去):
已知M是由X、Y两种位于同周期的元素组成的离子化合物,且X+与氖原子具有相同的电子层结构,Y元素的最高正价与它的负价代数和为6.M与相关物质的转化关系如图(部分产物已略去):