题目内容
对于常温下pH为2的盐酸,叙述正确的是( )
| A、c(H+)=c(Cl-)+c(OH-) |
| B、与等体积pH=12的氨水混合后所得溶液显酸性 |
| C、由H2O电离出的c(H+)=1.0×10-12mol?L-1 |
| D、与等体积0.01 mol?L-1乙酸钠溶液混合后溶液中:c(Cl-)=c(CH3COO-) |
考点:离子浓度大小的比较,酸碱混合时的定性判断及有关ph的计算
专题:
分析:A、溶液遵循电荷守恒;
B、与等体积pH=12的氨水混合后,氨水有剩余;
C、常温下Kw=1.0×10-14;
D、与等体积0.01 mol?L-1乙酸钠溶液混合后,生成NaCl和乙酸,溶液显酸性.
B、与等体积pH=12的氨水混合后,氨水有剩余;
C、常温下Kw=1.0×10-14;
D、与等体积0.01 mol?L-1乙酸钠溶液混合后,生成NaCl和乙酸,溶液显酸性.
解答:
解:A、因溶液遵循电荷守恒,则c(H+)=c(Cl-)+c(OH-),故A正确;
B、与等体积pH=12的氨水混合后,氨水有剩余,溶液显碱性,故B错误;
C、常温下Kw=1.0×10-14,pH=2的盐酸溶液中由H2O电离出的c(H+)=1.0×10-12mol?L-1,故C正确;
D.与等体积0.01 mol?L-1乙酸钠溶液混合后,生成NaCl和乙酸,溶液显酸性,c(H+)>c(OH-),由电离可知,c(Cl-)>c(CH3COO-),故D错误;
故选AC.
B、与等体积pH=12的氨水混合后,氨水有剩余,溶液显碱性,故B错误;
C、常温下Kw=1.0×10-14,pH=2的盐酸溶液中由H2O电离出的c(H+)=1.0×10-12mol?L-1,故C正确;
D.与等体积0.01 mol?L-1乙酸钠溶液混合后,生成NaCl和乙酸,溶液显酸性,c(H+)>c(OH-),由电离可知,c(Cl-)>c(CH3COO-),故D错误;
故选AC.
点评:本题考查酸碱混合溶液的定性分析,明确电荷守恒及pH与浓度的换算即可解答,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
 一定温度下,某容积恒定的密闭容器中发生如下可逆反应:
一定温度下,某容积恒定的密闭容器中发生如下可逆反应:CO(g)+H2(g)?C(s)+H2O(g);△H<0以l mol CO和2mol H2为起始反应物,tl时达到平衡,生成0.6mol H2O(g).t2时改变反应条件,化学反应速率(v)与时间(t)的关系如图所示.下列叙述正确的是( )
| A、起始时刻和t1达到平衡后气体的物质的量之比为5:4 |
| B、平衡后若加入少量碳,平衡向逆反应方向移动 |
| C、平衡后若加入氢气,上述反应的△H会增大 |
| D、t2时改变的条件可能是升高温度 |
 1993年一位农民偶然发现他的一头小母牛食用腐败草料后,血液不会凝固.一位化学家由此得到启发,从腐败草料中提取出结构简式为(如图)的双香豆素.关于双香豆素的下列推论中错误是( )
1993年一位农民偶然发现他的一头小母牛食用腐败草料后,血液不会凝固.一位化学家由此得到启发,从腐败草料中提取出结构简式为(如图)的双香豆素.关于双香豆素的下列推论中错误是( )| A、有望将它发展制得一种抗凝血药 |
| B、它无臭并略具芳香味,因而可用来制备致命性出血型的杀鼠药 |
| C、1mol双香豆素在碱性条件下水解可消耗NaOH4mol |
| D、它易溶于水、乙醇、乙醚等有机溶剂 |
下列溶液中有关物质的量浓度关系正确的是( )
| A、pH相等的CH3COONa、NaOH和Na2CO3三种溶液:c(NaOH)<c(CH3COONa)<c(Na2CO3) | ||
| B、已知0.1 mol?L-1 二元酸H2A溶液的pH=4,则在0.1 mol?L-1 Na2A溶液中:c(OH-)=c(HA-)+c(H+)+2c(H2A) | ||
| C、将0.1 mol?L-1醋酸溶液加水稀释,则溶液中的c(H+)和c(OH-)都减小 | ||
D、向0.1 mol?L-1的氨水中加入少量硫酸铵固体,则溶液中
|
下列判断中错误的是( )
| A、0.1 mol/L的某碱液其pH小于13而大于7,此碱为弱碱 |
| B、pH=1的某酸稀释10倍后,1<pH<2,此酸为弱酸 |
| C、pH=13的某碱稀释10倍后,12<pH<13,此碱为弱碱 |
| D、0.1 mol/L的某酸,被NaOH中和至pH=7时,所反应的NaOH物质的量大于该酸物质的量,则此酸为弱酸 |
化学与生活、社会密切相关.下列说法正确的是( )
| A、硫在过量的氧气中燃烧生成三氧化硫 |
| B、氢氧燃料电池、铅蓄电池、硅太阳能电池中都利用了原电池原理 |
| C、氨气溶于水显碱性,可以用湿润的红色石蕊试纸检验氨气的生成 |
| D、Mg可由电解熔融的MgCl2制取,Al也可由电解熔融AlCl3制取 |
反应2A(g)?2B(g)+E(g)(正反应为吸热反应)达到平衡时,要使正反应速率降低,A的浓度增大,应采取的措施是( )
| A、加压 | B、减压 |
| C、减少E的浓度 | D、降温 |
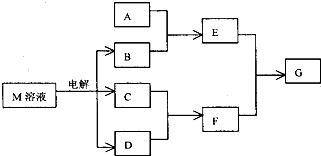 已知M是由X、Y两种位于同周期的元素组成的离子化合物,且X+与氖原子具有相同的电子层结构,Y元素的最高正价与它的负价代数和为6.M与相关物质的转化关系如图(部分产物已略去):
已知M是由X、Y两种位于同周期的元素组成的离子化合物,且X+与氖原子具有相同的电子层结构,Y元素的最高正价与它的负价代数和为6.M与相关物质的转化关系如图(部分产物已略去):