题目内容
10.在实验室进行下列实验,能达到实验目的是( )| A | B | C | D |
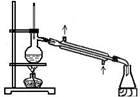 |  | 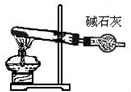 |  |
| 分离苯和硝基苯的混合物 | 吸收HCl气体,并防止倒吸 | 以NH4Cl为原料制取NH3 | 制取乙烯 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.苯和硝基苯的沸点不同,可用蒸馏的方法分离;
B.HCl直接通入水中,不能防止倒吸;
C.氯化铵分解生成的氨气、氯化氢在温度稍低时又易生成氯化铵;
D.应加入温度计控制温度.
解答 解:A.苯和硝基苯的沸点不同,可用蒸馏的方法分离,操作正确,故A正确;
B.HCl直接通入水中,不能防止倒吸,应用四氯化碳,故B错误;
C.氯化铵分解生成的氨气、氯化氢在温度稍低时又易生成氯化铵,应用氯化铵和氢氧化钙制备氨气,故C错误;
D.制备乙烯应加热到170℃,应加入温度计控制温度,故D错误.
故选A.
点评 本题考查化学实验方案的评价,为高频考点,把握实验原理及实验装置的作用为解答的关键,明确实验基本操作和物质的性质即可解答,注意实验的评价性和操作性分析,题目难度不大.

练习册系列答案
 小学夺冠AB卷系列答案
小学夺冠AB卷系列答案 ABC考王全优卷系列答案
ABC考王全优卷系列答案
相关题目
18.下列分子中有2个手性碳原子的是( )
| A. | 乳酸:CH3-CHOH-COOH | |
| B. | 甘油:CH2OH-CHOH-CH2OH | |
| C. | 脱氧核糖:CH2OH-CHOH-CHOH-CH2-CHO | |
| D. | 核糖:CH2OH-CHOH-CHOH-CHOH-CHO |
5.七种短周期元素在元素周期表中的相对位置如表所示.其中B的最高价氧化物的水化物能与B的气态氢化物反应生成离子化合物,下列说法不正确的是( )
| A | B | C | ||
| D | E | F | G |
| A. | G的最高价氧化物对应的水化物是最强的酸 | |
| B. | 熔融电解化合物D2C3可制取单质D | |
| C. | F的最高价含氧酸的浓溶液与单质A共热时能生成三种氧化物 | |
| D. | A、G分别与氢元素形成的化合物中,化学键均为极性共价键 |
15.如图是某同学设计的制备少量氯气并进行系列实验的装置(夹持及加热仪器已略).
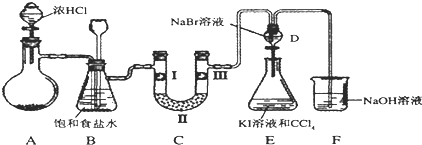
(1)若装置A中制备氯气选用的药品为固体二氧化锰和浓盐酸,请写出装置A中的化学反应方程式:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O;
实验室也可用高锰酸钾制氯气:2KMnO4+16HCl(浓)=5Cl2↑+2MnCl2+2KCl+8H2O
该反应中的氧化剂是KMnO4,若消耗0.2mol氧化剂,则被氧化的还原剂的物质的量是1mol;
(2)装置B中饱和食盐水的作用是除去Cl2中的HCl;
(3)装置C的实验目的是验证氯气是否具有漂白性,为此C中I、II、III依次放入d(填编号);(碱石灰为NaOH与CaO混合物,无水氯化钙为中性干燥剂)
(4)设计装置D、E的目的是比较氯、溴、碘单质的氧化性强弱.当向D中缓缓通入少量氯气时,可以看到D中无色溶液逐渐变为橙黄色,若打开D装置的活塞,使D中溶液滴入E装置(KI溶液与CCl4),振荡锥形瓶后静置一会儿,可以观察到的现象是E中液体分为两层,下层(CCl4层)为紫红色;
(5)装置F中用足量的NaOH溶液吸收余氯,试写出相应的化学方程式2NaOH+Cl2=NaCl+NaClO+H2O.

(1)若装置A中制备氯气选用的药品为固体二氧化锰和浓盐酸,请写出装置A中的化学反应方程式:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O;
实验室也可用高锰酸钾制氯气:2KMnO4+16HCl(浓)=5Cl2↑+2MnCl2+2KCl+8H2O
该反应中的氧化剂是KMnO4,若消耗0.2mol氧化剂,则被氧化的还原剂的物质的量是1mol;
(2)装置B中饱和食盐水的作用是除去Cl2中的HCl;
(3)装置C的实验目的是验证氯气是否具有漂白性,为此C中I、II、III依次放入d(填编号);(碱石灰为NaOH与CaO混合物,无水氯化钙为中性干燥剂)
| a | b | c | d | |
| I | 干燥的有色布条 | 干燥的有色布条 | 湿润的有色布条 | 湿润的有色布条 |
| II | 碱石灰 | 无水氯化钙 | 碱石灰 | 无水氯化钙 |
| III | 湿润的有色布条 | 湿润的有色布条 | 干燥的有色布条 | 干燥的有色布条 |
(5)装置F中用足量的NaOH溶液吸收余氯,试写出相应的化学方程式2NaOH+Cl2=NaCl+NaClO+H2O.
2.下列变化中证明硫酸是强酸的是( )
| A. | 和铜反应 | B. | 和锌反应放出H2 | ||
| C. | 与NaCl反应制HCl | D. | 与Ca3(PO4)2反应制H3PO4 |
 对叔丁基苯酚
对叔丁基苯酚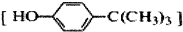 工业用途广泛,可用于生产油溶性酚醛树脂、稳定剂和香料等.实验室以苯酚、叔丁基氯[(CH3)3CCl]等为原料制备对叔丁基苯酚.实验步骤如下:反应物和产物的相关数据列表如下:
工业用途广泛,可用于生产油溶性酚醛树脂、稳定剂和香料等.实验室以苯酚、叔丁基氯[(CH3)3CCl]等为原料制备对叔丁基苯酚.实验步骤如下:反应物和产物的相关数据列表如下: .该反应过于激烈,放出大量热,常使实验的产率降低,可能的原因是由于叔丁基氯挥发导致产率降低.
.该反应过于激烈,放出大量热,常使实验的产率降低,可能的原因是由于叔丁基氯挥发导致产率降低.