题目内容
15.如图是某同学设计的制备少量氯气并进行系列实验的装置(夹持及加热仪器已略).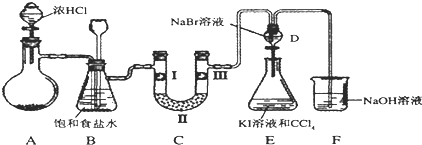
(1)若装置A中制备氯气选用的药品为固体二氧化锰和浓盐酸,请写出装置A中的化学反应方程式:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O;
实验室也可用高锰酸钾制氯气:2KMnO4+16HCl(浓)=5Cl2↑+2MnCl2+2KCl+8H2O
该反应中的氧化剂是KMnO4,若消耗0.2mol氧化剂,则被氧化的还原剂的物质的量是1mol;
(2)装置B中饱和食盐水的作用是除去Cl2中的HCl;
(3)装置C的实验目的是验证氯气是否具有漂白性,为此C中I、II、III依次放入d(填编号);(碱石灰为NaOH与CaO混合物,无水氯化钙为中性干燥剂)
| a | b | c | d | |
| I | 干燥的有色布条 | 干燥的有色布条 | 湿润的有色布条 | 湿润的有色布条 |
| II | 碱石灰 | 无水氯化钙 | 碱石灰 | 无水氯化钙 |
| III | 湿润的有色布条 | 湿润的有色布条 | 干燥的有色布条 | 干燥的有色布条 |
(5)装置F中用足量的NaOH溶液吸收余氯,试写出相应的化学方程式2NaOH+Cl2=NaCl+NaClO+H2O.
分析 (1)二氧化锰与浓盐酸在加热条件下反应生成氯气、氯化锰和水;
依据方程式2KMnO4+16HCl(浓)=5Cl2↑+2MnCl2+2KCl+8H2O分析元素化合价变化判断氧化剂,计算消耗0.2mol氧化剂,则被氧化的还原剂的物质的量;
(2)浓盐酸具有挥发性,制备的氯气中含有氯化氢,依据氯化氢、氯气在饱和食盐水中溶解性选择除杂试剂;
(3)验证氯气是否具有漂白性,要验证干燥氯气无漂白性,湿润的有色布条中,氯气和水反应生成次氯酸具有漂白性;
(4)D中是溴化钠,当向D中缓缓通入少量氯气时,氯气和溴化钠反应生成溴单质;打开活塞,将装置D中含溴单质的少量溶液加入含碘化钾和CCl4的装置E中,溴单质和碘化钾反应生成碘单质,碘单质溶于苯呈紫红色;
(5)氯气有毒,能够与氢氧化钠反应生成氯化钠、次氯酸钠和水,可以用氢氧化钠吸收.
解答 解:(1)二氧化锰与浓盐酸在加热条件下反应生成氯气、氯化锰和水,化学方程式:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O;
依据方程式2KMnO4+16HCl(浓)=5Cl2↑+2MnCl2+2KCl+8H2O 反应中锰元素化合价降低,所以氧化剂为高锰酸钾,还原剂为氯化氢,16mol氯化氢参加反应,只有10mol被氧化,所以若消耗0.2mol氧化剂,则被氧化的还原剂的物质的量是1mol;
故答案为:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O;KMnO4,1;
(2)反应过程中氯化氢和水蒸气是氯气中的杂质,装置B中饱和食盐水的作用是除去Cl2中的HCl;装置B亦是安全瓶,监测实验进行时C中是否发生堵塞,发生堵塞时B中的,压强增大,B中长颈漏斗中液面上升,形成水柱;
故答案为:除去Cl2中的HCl;
(3)装置C的实验目的是验证氯气是否具有漂白性,验证氯气是否具有漂白性,要验证干燥氯气无漂白性,湿润的有色布条中,氯气和水反应生成次氯酸具有漂白性,所以C中I、II、III依次放入湿润的有色布条、无水氯化钙、干燥的有色布条,故应选择d;
故答案为:d;
(4)D中是溴化钠,当向D中缓缓通入少量氯气时,氯气和溴化钠反应生成溴单质,可以看到无色溶液逐渐变为黄,所以现象为:溶液从无色变化为黄色;打开活塞,将装置D中含溴单质的少量溶液加入含碘化钾和CCl4的装置E中,溴单质和碘化钾反应生成碘单质,碘单质溶于苯呈紫红色,振荡.观察到的现象是:E中溶液分为两层,下层(四氯化碳层)为紫红色;
故答案为:橙黄; E中液体分为两层,下层(CCl4层)为紫红色;
(5)用足量的NaOH溶液吸收余氯,相应的化学方程式为:2NaOH+Cl2=NaCl+NaClO+H2O,故答案为:2NaOH+Cl2=NaCl+NaClO+H2O.
点评 本题考查了氯气实验室制取,氯气化学性质的应用,实验设计,实验装置的原理分析,化学方程式的书写,明确氯气制备原理和性质是解题关键,题目难度中等.

 智能训练练测考系列答案
智能训练练测考系列答案| A. | 镁与稀硝酸反应:Mg+2H+═Mg2++H2↑ | |
| B. | 氯化铝溶液与氨水反应:Al3++3OH-═Al(OH)3↓ | |
| C. | 三氯化铁腐蚀印刷线路板:2Fe3++Cu═2Fe2++Cu2+ | |
| D. | 硫酸溶液与氢氧化钡溶液反应:H++SO42-+OH-+Ba2+═BaSO4↓+H2O |
| A. | 元素的单质氧化性:Z>Y>X | B. | 最高正化合价:Z>Y | ||
| C. | 原子半径:Z<Y<X | D. | 气态氢化物的稳定性:Z<Y<X |
| A. | 乙中C的转化率为20% | |
| B. | Q1+Q2=Q | |
| C. | 达到平衡后,再向乙中加入0.25 molA、0.75molB、1.5molC,平衡向正反应方向移动 | |
| D. | 乙中的热化学反应方程式为2C(g)?A(g)+3B(g);△H=+Q2kJ•mol-1 |


 某研究性学习小组在研究二氧化硫漂白作用时,从“氯气的漂白作用实际上是氯气与水反应生成的次氯酸的漂白作用”得到启发.为了探究二氧化硫作用得到底是二氧化硫本身还是二氧化硫与水作用的产物,该小组设计了如下实验.请回答相关问题.
某研究性学习小组在研究二氧化硫漂白作用时,从“氯气的漂白作用实际上是氯气与水反应生成的次氯酸的漂白作用”得到启发.为了探究二氧化硫作用得到底是二氧化硫本身还是二氧化硫与水作用的产物,该小组设计了如下实验.请回答相关问题.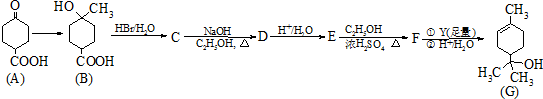
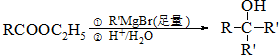
 .
.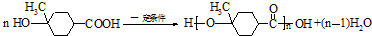 .
. .
.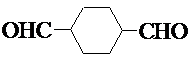 .
.