题目内容
20.A、B、C、D、E是中学常见的5种化合物,A、B是氧化物,元素X、Y的单质是生活中常见的金属,相关物质间的关系如图所示.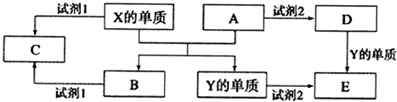
(1)X的单质与A反应的化学方程式是Fe2O3+2Al$\frac{\underline{\;高温\;}}{\;}$Al2O3+2Fe.
(2)若试剂1是NaOH溶液.X的单质与试剂1反应的离子方程式是2Al+2H2O+2OH-═2AlO2-+3H2↑.
(3)若试剂1和试剂2均是稀硫酸.
①检验物质D的溶液中金属离子的方法是取少量溶液于试管中,滴加几滴KSCN溶液,溶液变红色,则证明原溶液中含有Fe3+.
②1molC物质与NaOH溶液反应,产生0.5mol沉淀,需消耗NaOH的物质的量为1.5mol或4.5mol.
③某高效净水剂是由Y(OH)SO4聚合得到的.工业上以E、稀硫酸和亚硝酸钠为原料来制备Y(OH)SO4,反应中有NO生成,该反应的化学方程式是2FeSO4+2NaNO2+H2SO4═2Fe(OH)SO4+Na2SO4+2NO↑.
分析 元素X、Y的单质是生活中常见的金属,Y的用量最大,则X为Al,Y为Fe,A、B是氧化物,则Al与氧化铁反应生成Fe和氧化铝;Al、氧化铝都既能与酸反应又能与碱反应,而Fe、氧化铁都能与酸反应,则试剂1为NaOH溶液时,C为偏铝酸钠;试剂2为硫酸时,D为硫酸铁、E为硫酸亚铁;试剂1为硫酸时,C为硫酸铝,该溶液水解显酸性,最后结合化学用语来解答即可.
解答 解:元素X、Y的单质是生活中常见的金属,Y的用量最大,则X为Al,Y为Fe,A、B是氧化物,则Al与氧化铁反应生成Fe和氧化铝;Al、氧化铝都既能与酸反应又能与碱反应,而Fe、氧化铁都能与酸反应,则试剂1为NaOH溶液时,C为偏铝酸钠;试剂2为硫酸时,D为硫酸铁、E为硫酸亚铁;试剂1为硫酸时,C为硫酸铝,该溶液水解显酸性,
(1)X的单质与A反应为铝热反应,即Al与氧化铁反应生成氧化铝和Fe,该反应为Fe2O3+2Al$\frac{\underline{\;高温\;}}{\;}$Al2O3+2Fe,
故答案为:Fe2O3+2Al$\frac{\underline{\;高温\;}}{\;}$Al2O3+2Fe;
(2)若试剂1是NaOH溶液,①Al与NaOH溶液反应生成偏铝酸钠和氢气,离子反应为2Al+2H2O+2OH-═2AlO2-+3H2↑,
故答案为:2Al+2H2O+2OH-═2AlO2-+3H2↑;
(3)若试剂1和试剂2均是稀硫酸,
①D为硫酸铁,检验铁离子的方法为取少量溶液于试管中,滴加几滴KSCN溶液,溶液变红色,则证明原溶液中含有Fe3+,
故答案为:取少量溶液于试管中,滴加几滴KSCN溶液,溶液变红色,则证明原溶液中含有Fe3+;
②C为硫酸铝,1molC物质与NaOH溶液反应,产生0.5mol沉淀,根据铝离子与氢氧化铝的物质的量的关系,铝元素没有完全转化成氢氧化铝,当1molAl3+生成0.5molAl(OH)3,还有0.5molAl3+未反应,则需消耗NaOH的物质的量为1.5mol,当1molAl3+生成0.5molAl(OH)3,还有0.5mol Al3+生成 AlO2-,则需消耗NaOH的物质的量为4.5mol,
故答案为:1.5mol或4.5mol;
③E为硫酸亚铁,与稀硫酸和亚硝酸钠为原料生成Fe(OH)SO4,反应中有NO生成,该反应为2FeSO4+2NaNO2+H2SO4═2Fe(OH)SO4+Na2SO4+2NO↑,
故答案为:2FeSO4+2NaNO2+H2SO4═2Fe(OH)SO4+Na2SO4+2NO↑.
点评 本题考查无机物的推断,明确铝热反应及Al、氧化铝、Fe、氧化铁的性质即可解答,并注意试剂1可以为酸或强碱来分析解答,题目难度不大.

| A. | 配制5% NaCl溶液时,将已准确称量的NaCl放入烧杯中并加适量的水搅拌溶解 | |
| B. | 配制1mol•L-1 Na0H溶液时,将溶解后的NaOH溶液立即注入容量瓶 | |
| C. | 配制0.1mol•L-1的H2SO4溶液时,将量取的浓H2SO4放入容量瓶中加水稀释 | |
| D. | 配制1mol•L-1 Na2CO3溶液500mL,将Na2CO3放在托盘天平右盘称量 |
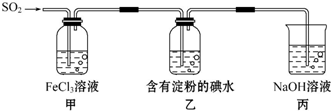
| A. | 为了验证Fe3+被SO2还原得到Fe2+,可向甲中加入KMnO4溶液,看紫红色是否褪去 | |
| B. | 甲中加入用稀盐酸酸化的BaCl2溶液,产生白色沉淀说明SO2可以被Fe3+氧化 | |
| C. | 能表明I-的还原性弱于SO2的现象是乙中蓝色溶液褪色 | |
| D. | 装置丙的作用是吸收SO2尾气,防止污染空气 |
| A. | NaCl、HCl、NaAlO2、NaHCO3 | B. | NaSO4、KNO3、(NH4)2SO4、MgCl2 | ||
| C. | FeCl3、NaOH、AlCl3、HNO3 | D. | AgNO3、NaCl、NaSO4、NaI |
 (g)$?_{高温}^{FeSO_{4}/Al_{2}O_{3}}$
(g)$?_{高温}^{FeSO_{4}/Al_{2}O_{3}}$ (g)+3H2(g)
(g)+3H2(g)