题目内容
1.已知反应FeO(s)+CO(g)?Fe(s)+CO2(g) 的Kc=0.5(1273K).若起始浓度c(CO)=0.05mol•L-1,c(CO2)=0.01mol•L-1,请回答:(1)判断化学反应进行的方向并计算反应物、生成物的平衡浓度.
(2)CO的转化率是多少?
分析 (1)依据浓度商计算和平衡常数比较分析反应进行的方向,注意固体不写入平衡常数和浓度商的计算式子,根据化学三段式列式计算平衡浓度;
(2)依据(1)的计算,结合转化率是消耗量除以起始量计算CO的转化率.
解答 解:(1)FeO(s)+CO(g)=Fe(s)+CO2(g)的K=0.5(1273K).若起始浓度c(CO)=0.05mol/L,c(CO2)=0.01mol•L-1,浓度商Q=$\frac{c(C{O}_{2})}{c(CO)}$═$\frac{0.01mol/L}{0.05mol/L}$=0.2<0.5,说明反应向正向反应进行;依据化学平衡三段式列式计算,设消耗一氧化碳浓度为x,得到
FeO(s)+CO(g)=Fe(s)+CO2(g)
起始量(mol/L) 0.05 0.01
变化量(mol/L) x x
平衡量(mol/L) 0.05-x 0.01+x
则:K=$\frac{c(C{O}_{2})}{c(CO)}$=$\frac{0.01+x}{0.05-x}$=0.5,
解得:x=0.01mol/L,
平衡后各物质的浓度c(CO2)=0.01mol/L+0.01mol/L=0.02mol/L;c(CO)=0.05mol/L-0.01mol/L=0.04mol/L,
答:化学反应向正反应方向进行,一氧化碳浓度为0.04mol/L,二氧化碳浓度为0.02mol/L;
(2)一氧化碳的转化率=$\frac{0.01mol/L}{0.05mol/L}$×100%=20%,
答:平衡后一氧化碳的转化率为20%.
点评 本题考查了化学平衡的计算,题目难度中等,注意掌握化学平衡及其影响,明确三段式在化学计算中的应用方法,试题培养了学生的分析能力及化学计算能力.

| A. | 配制5% NaCl溶液时,将已准确称量的NaCl放入烧杯中并加适量的水搅拌溶解 | |
| B. | 配制1mol•L-1 Na0H溶液时,将溶解后的NaOH溶液立即注入容量瓶 | |
| C. | 配制0.1mol•L-1的H2SO4溶液时,将量取的浓H2SO4放入容量瓶中加水稀释 | |
| D. | 配制1mol•L-1 Na2CO3溶液500mL,将Na2CO3放在托盘天平右盘称量 |
| A. | NaCl、HCl、NaAlO2、NaHCO3 | B. | NaSO4、KNO3、(NH4)2SO4、MgCl2 | ||
| C. | FeCl3、NaOH、AlCl3、HNO3 | D. | AgNO3、NaCl、NaSO4、NaI |
| A. | 镁与稀硝酸反应:Mg+2H+═Mg2++H2↑ | |
| B. | 氯化铝溶液与氨水反应:Al3++3OH-═Al(OH)3↓ | |
| C. | 三氯化铁腐蚀印刷线路板:2Fe3++Cu═2Fe2++Cu2+ | |
| D. | 硫酸溶液与氢氧化钡溶液反应:H++SO42-+OH-+Ba2+═BaSO4↓+H2O |

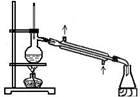
| A. | 甲装置:可用来证明硫的非金属性比硅强 | |
| B. | 乙装置:用盐酸标准液测氢氧化钠溶液浓度 | |
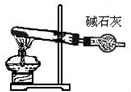
| C. | 丙装置:配制一定物质的量浓度的氢氧化钠溶液 | |
| D. | 丁装置:可在瓶中先装满水,气体由②口入,收集NO气体 |
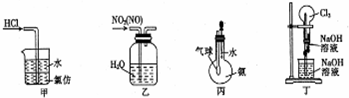
| A. | 装置甲:用于吸收HCl气体 | B. | 装置乙:用于除去NO2中的NO | ||
| C. | 装置丙:可验证氨气极易溶于水 | D. | 装置丁:可形成喷泉 |