题目内容
一定量的混合气体在密闭容器中发生如下反应:mA(g)+nB(g)?pC(g),达平衡后,保持温度不变,将容器的体积缩小为原来的
,当达到新平衡时,测得C的浓度为原来的1.9倍.则下列叙述中正确的是( )
| 1 |
| 2 |
| A、m+n>p |
| B、A的转化率增大 |
| C、平衡逆向移动 |
| D、C的体积百分含量增大 |
考点:化学平衡的计算
专题:
分析:mA(g)+nB(g)?pC(g),达到平衡后,温度不变,将气体体积压缩到
,若平衡不移动,C的浓度为原来的2倍,当达到平衡时C的浓度为原来的1.9倍,则体积减小时平衡逆向移动,以此来解答.
| 1 |
| 2 |
解答:
解:mA(g)+nB(g)?pC(g),达到平衡后,温度不变,将气体体积压缩到
,若平衡不移动,C的浓度为原来的2倍,当达到平衡时C的浓度为原来的1.9倍,则体积减小时平衡逆向移动,
A.体积缩小,相当于加压,平衡逆向移动,则m+n<p,故A错误;
B.平衡逆向移动,A的转化率减小,故B错误;
C.由上述分析可知,平衡逆向移动,故C正确;
D.平衡逆向移动,C的体积分数减小,但比原来的大,故D错误;
故选C.
| 1 |
| 2 |
A.体积缩小,相当于加压,平衡逆向移动,则m+n<p,故A错误;
B.平衡逆向移动,A的转化率减小,故B错误;
C.由上述分析可知,平衡逆向移动,故C正确;
D.平衡逆向移动,C的体积分数减小,但比原来的大,故D错误;
故选C.
点评:本题考查影响平衡移动的因素,注意把握“体积压缩到
,当达到平衡时C的浓度为原来的1.9倍”为解答的关键信息,题目难度中等.
| 1 |
| 2 |

练习册系列答案
相关题目
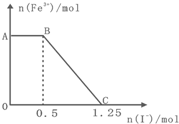 已知酸性高锰酸钾溶液可以将FeSO4氧化,化学反应方程式为:
已知酸性高锰酸钾溶液可以将FeSO4氧化,化学反应方程式为:2KMnO4+10FeSO4+8H2SO4═K2SO4+2MnSO4+5Fe2(SO4)3+8H2O,现将一定量的硫酸酸化的高锰酸钾溶液与硫酸亚铁溶液混合,充分反应后再向所得溶液中加入KI溶液(假设I-与KMnO4反应的氧化产物为I2),混合溶液中铁离子的物质的量随加入的KI的物质的量的变化关系如图所示,则下列有关说法不正确的是( )
| A、图中AB段主要是高锰酸钾和碘化钾溶液反应 | ||||
| B、图中BC段发生的反应为2Fe3++2I-═2Fe2++I2通电 | ||||
| C、根据OC段的数据可知开始加入的高锰酸钾的物质的量为0.25mol | ||||
D、以Pt为电极材料电解C点的溶液,总反应式为2H2O
|
在恒温、容积为2L的密闭容器中充入2mol SO2和一定量O2.发生反应2SO2+O2?2SO3,当反应进行到4min时,测得n(SO2)=0.4mol.若反应进行到2min时,容器中SO2的物质的量是( )
| A、等于1.6 mol |
| B、等于1.2 mol |
| C、大于1.6 mol |
| D、小于1.2 mol |
实验室制取乙酸乙酯1mL后,沿小试管壁加入紫色石蕊试液0.5mL,这时石蕊试液将存在于饱和碳酸钠层与乙酸乙酯层之间(整个过程不振荡试管),对可能出现的现象,叙述正确的是( )※重要提示:Na2CO3溶液显碱性.
| A、石蕊层仍为紫色 |
| B、石蕊层有两层,上层为紫色,下层为蓝色 |
| C、石蕊层为三层环,由上而下是蓝色、紫色、红色 |
| D、石蕊层为三层环,由上而下是红色、紫色、蓝色. |
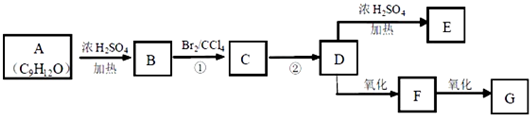

 .写出有关反应的化学方程式.
.写出有关反应的化学方程式.