题目内容
(1)一定条件下,可逆反应:A2(g)+B2(g)?2C(g)达到平衡时,各物质的平衡浓度分别为:c(A2)=0.5mol?L-1;c(B2)=0.1mol?L-1;c(C)=1.6mol?L-1.若用a、b、c分别表示A2、B2、C的初始浓度(mol?L-1),则:
①a、b应满足的关系式是 .
②a的取值范围是 .
(2)氮元素的氢化物和氧化物在工业生产和国防建设中都有广泛应用,肼(N2H4)可作为火箭发动机的燃料,与氧化剂N2O4反应生成N2和水蒸气.已知:
①N2(g)+2O2(g)═N2O4 (1)△H1=-19.5kJ?mol-1
②N2H4(1)+O2(g)═N2(g)+2H2O(g)△H2=-534.2kJ?mol-1
写出肼和N2O4 反应的热化学方程式 .
①a、b应满足的关系式是
②a的取值范围是
(2)氮元素的氢化物和氧化物在工业生产和国防建设中都有广泛应用,肼(N2H4)可作为火箭发动机的燃料,与氧化剂N2O4反应生成N2和水蒸气.已知:
①N2(g)+2O2(g)═N2O4 (1)△H1=-19.5kJ?mol-1
②N2H4(1)+O2(g)═N2(g)+2H2O(g)△H2=-534.2kJ?mol-1
写出肼和N2O4 反应的热化学方程式
考点:化学平衡的计算,热化学方程式
专题:基本概念与基本理论
分析:(1)①根据参加反应的A2和B2的浓度相同,故二者平衡浓度之差应等于起始浓度之差,依此进行计算;
②平衡从正向和逆向分别建立,依此利用三段式进行计算;
(2)依据热化学方程式和盖斯定律计算得到所需热化学方程式.
②平衡从正向和逆向分别建立,依此利用三段式进行计算;
(2)依据热化学方程式和盖斯定律计算得到所需热化学方程式.
解答:
解:(1)①A2(g)+B2(g)?2C(g),参加反应的A2和B2的浓度相同,故二者平衡浓度之差应等于起始浓度之差,即a-b=0.5-0.1=0.4,
故答案为:a=b+0.4;
②若平衡从正向建立,则
A2(g)+B2(g)?2C(g)
起始:a b 0
转化:a-0.5 b-0.1 1.6
平衡:0.5 0.1 1.6
,a=1.3mol/L,
若平衡从逆向建立,则
A2(g)+B2(g)?2C(g)
起始:a 0 c
转化:0.1 0.1 0.2
平衡:0.5 0.1 1.6
a+0.1=0.5,a=0.4mol/L,
故a的取值范围为:0.4≤a≤1.3
故答案为:0.4≤a≤1.3;
(2)①N2(g)+2O2(g)═N2O4 (1)△H1=-19.5kJ?mol-1
②N2H4(1)+O2(g)═N2(g)+2H2O(g)△H2=-534.2kJ?mol-1
依据盖斯定律②×2-①得到肼和N2O4 反应的热化学方程式:2N2H4(1)+N2O4 (1)=3N2(g)+4H2O(g)△H=-1048.9KJ/mol;
故答案为;2N2H4(1)+N2O4 (1)=3N2(g)+4H2O(g)△H=-1048.9KJ/mol.
故答案为:a=b+0.4;
②若平衡从正向建立,则
A2(g)+B2(g)?2C(g)
起始:a b 0
转化:a-0.5 b-0.1 1.6
平衡:0.5 0.1 1.6
| a-0.5 |
| 1.6 |
若平衡从逆向建立,则
A2(g)+B2(g)?2C(g)
起始:a 0 c
转化:0.1 0.1 0.2
平衡:0.5 0.1 1.6
a+0.1=0.5,a=0.4mol/L,
故a的取值范围为:0.4≤a≤1.3
故答案为:0.4≤a≤1.3;
(2)①N2(g)+2O2(g)═N2O4 (1)△H1=-19.5kJ?mol-1
②N2H4(1)+O2(g)═N2(g)+2H2O(g)△H2=-534.2kJ?mol-1
依据盖斯定律②×2-①得到肼和N2O4 反应的热化学方程式:2N2H4(1)+N2O4 (1)=3N2(g)+4H2O(g)△H=-1048.9KJ/mol;
故答案为;2N2H4(1)+N2O4 (1)=3N2(g)+4H2O(g)△H=-1048.9KJ/mol.
点评:本题考查了化学平衡计算,极值分析方法是计算取值范围的依据,热化学方程式书写和盖斯定律计算应用,掌握基础是关键,题目较简单.

练习册系列答案
相关题目
在下列实验中,不能达到目的是( )
| A、Fe与Cl2反应生成FeCl3,Fe与S反应生成FeS,确定非金属性:Cl>S |
| B、用石墨作电极,电解Mg(NO3)2、Cu(NO3)2的混合溶液,确定铜、镁的金属活动性强弱 |
| C、进行H2O和H2S的热分解实验,确定硫和氧两种元素的非金属性强弱 |
| D、测定NaCl和NaF溶液的pH,确定F、Cl两元素非金属性的强弱 |
某铜片表面附着黑色固体,可能含有CuO、Cu2S、CuS.查阅资料得知:常温下,Cu2S和CuS都不溶于稀盐酸,在空气中煅烧都转化为Cu2O 和SO2.实验小组按如下实验方案探究其成分:
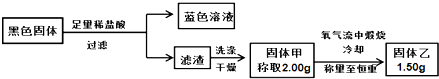
根据信息推测黑色固体的成分是( )

根据信息推测黑色固体的成分是( )
| A、只有CuO |
| B、CuO、Cu2S和CuS |
| C、CuO、CuS |
| D、CuO、Cu2S |
下列说法正确的是( )
| A、由石墨比金刚石稳定可知:C(金刚石,s)═C(石墨,s)△H<0 |
| B、在101 kPa时,1 mol H2完全燃烧生成液态水,放出285.8 kJ热量,H2的燃烧热为-285.8 kJ?mol-1 |
| C、在101 kPa时,1 mol C与适量O2反应生成1 mol CO时,放出110.5 kJ热量,则C的燃烧热为110.5 kJ?mol-1 |
| D、在稀溶液中:H+ (aq)+OH- (aq)═H2O(l)△H=-57.31 kJ?mol-1,若将含0.5 mol H2SO4的浓硫酸与含1 mol NaOH的溶液混合,放出的热量等于57.31 kJ |
将铜投入稀硫酸中不能溶解,但向这种稀硫酸中加入下列某种物质后,发现铜能逐渐溶解,溶液逐渐变成蓝色,并可见有气体产生.则向这种稀硫酸中加入的物质是( )
| A、盐酸 | B、硝酸钾 |
| C、氯化钡 | D、氯化铁 |
一定量的混合气体在密闭容器中发生如下反应:mA(g)+nB(g)?pC(g),达平衡后,保持温度不变,将容器的体积缩小为原来的
,当达到新平衡时,测得C的浓度为原来的1.9倍.则下列叙述中正确的是( )
| 1 |
| 2 |
| A、m+n>p |
| B、A的转化率增大 |
| C、平衡逆向移动 |
| D、C的体积百分含量增大 |

 (图中②、④、⑨分别位于晶胞的体心、顶点、面心),则该化合物的化学式为
(图中②、④、⑨分别位于晶胞的体心、顶点、面心),则该化合物的化学式为 为了确认CH3COOH、H2CO3和H2SiO3的酸性强弱,有人设计用如图所示装置,一次实验达到目的(不能再选用其他酸性溶液).
为了确认CH3COOH、H2CO3和H2SiO3的酸性强弱,有人设计用如图所示装置,一次实验达到目的(不能再选用其他酸性溶液).