题目内容
8.(1)在同温同压下,等物质的量的CO和CO2,二者质量比为7:11,所含原子的个数比为2:3,体积比是1:1.(2)质量相等的CO和CO2,二者的物质的量之比为11:7,在同温同压下,它们的密度比为7:11,所含氧原子物质的量比为11:14
(3)15.6g Na2X含Na+0.4mol,则Na2X的摩尔质量为78g/mol,X的相对原子质量为32.
分析 根据n=$\frac{m}{M}$=$\frac{V}{{V}_{m}}$=$\frac{N}{{N}_{A}}$结合分子的构成计算.
解答 解:(1)由n=$\frac{V}{{V}_{m}}$可知,等物质的量的CO和CO2,二者体积比为1:1,
根据N=nNA可知,分子数之比等于物质的量之比,
而1个CO分子中含有1个C原子,1个O原子,1个CO2分子中含有1个C原子,2个O原子,
所以:等物质的量的CO和CO2中所含原子个数之比2:3,
m=nM,二者的质量之比为:m(CO):m(CO2)=28:44=7:11,
故答案为:7:11; 2:3;1:1;
(2)令CO和CO2的质量都是1g,CO的物质的量=$\frac{1g}{28g/mol}$=$\frac{1}{28}$mol,CO2的物质的量=$\frac{1g}{44g/mol}$=$\frac{1}{44}$mol,
根CO和CO2物质的量之比=$\frac{1}{28}$mol:$\frac{1}{44}$mol=11:7;
同温同压下,气体的密度之比等于其摩尔质量之比,CO2和CO的密度之比为44g/mol:28g/mol=11:7,
所含氧原子物质的量比为11:7×2=11:14;
故答案为:11:7;7:11;11:14;
(3)n(Na2X)=$\frac{1}{2}$n(Na+)=0.2mol,M(Na2X)=$\frac{15.6g}{0.2mol}$=78g/mol,X的相对原子质量为78-2×23=32,
故答案为:78g/mol;32.
点评 本题考查阿伏伽德罗定律及其推论、物质的量的计算,比较基础,注意对基础知识的理解掌握.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
18.丙酮是一种常用的有机溶剂,可与水以任意体积比互溶,沸点约55℃,分离水和丙酮时最合理的方法是( )
| A. | 蒸馏 | B. | 分液 | C. | 过滤 | D. | 蒸发 |
19.(1)为达下表所列实验目的,请选择合适的实验方法,将其标号填在相应的空格中.
A、加热至恒重 B、用氢氧化钠溶液溶解后过滤
C.溶解、过滤、结晶 D.滴加KSCN溶液观察是否溶液是否变红
(2)实验室有甲、乙两瓶无色溶液,其中一瓶是稀盐酸,另一瓶是碳酸钠溶液.为鉴别两溶液,进行以下实验:取甲溶液于试管,向其中缓慢滴入乙溶液,并边滴加边振荡,观察到开始无明显现象,后来有大量气体生成.甲是Na2CO3溶液;
实验过程中所发生反应的离子方程式为:CO32-+H+=HCO3-、HCO3-+H+=CO2+H2O;
(3)将CO2和SO2气体分别通入酸性高锰酸钾,使之褪色的是SO2气体,请写出该反应的离子方程式:5SO2+2MnO4-+2H2O=2Mn2++5SO42-+4H+.
| 实验目的 | 标号 |
| 检验氯化亚铁是否变质 | |
| 除去食盐中少量细砂 | |
| 除去碳酸钠固体中少量碳酸氢钠 | |
| 除去镁粉中混有的少量铝粉 |
C.溶解、过滤、结晶 D.滴加KSCN溶液观察是否溶液是否变红
(2)实验室有甲、乙两瓶无色溶液,其中一瓶是稀盐酸,另一瓶是碳酸钠溶液.为鉴别两溶液,进行以下实验:取甲溶液于试管,向其中缓慢滴入乙溶液,并边滴加边振荡,观察到开始无明显现象,后来有大量气体生成.甲是Na2CO3溶液;
实验过程中所发生反应的离子方程式为:CO32-+H+=HCO3-、HCO3-+H+=CO2+H2O;
(3)将CO2和SO2气体分别通入酸性高锰酸钾,使之褪色的是SO2气体,请写出该反应的离子方程式:5SO2+2MnO4-+2H2O=2Mn2++5SO42-+4H+.
3.下列说法中正确的是( )
①钠在空气中燃烧生成白色的氧化钠
②钠投入硫酸铜稀溶液中有红色粉末产生
③过氧化钠可在防毒面具中做供氧剂
④铁丝在氯气中燃烧生成棕褐色的烟
⑤钠、氢气在氯气中燃烧都能产生白烟.
①钠在空气中燃烧生成白色的氧化钠
②钠投入硫酸铜稀溶液中有红色粉末产生
③过氧化钠可在防毒面具中做供氧剂
④铁丝在氯气中燃烧生成棕褐色的烟
⑤钠、氢气在氯气中燃烧都能产生白烟.
| A. | ①② | B. | ②③ | C. | ③④ | D. | ④⑤ |
17.对于反应2P+4H2O2+2NaOH═Na2H2P2O6+4H2O,下列有关该反应说法正确的是( )
| A. | P是氧化剂 | B. | 氧化性H2O2>Na2H2P2O6 | ||
| C. | 1mol H2O2反应,转移电子1mol | D. | Na2H2P2O6中磷元素的化合价为+3 |


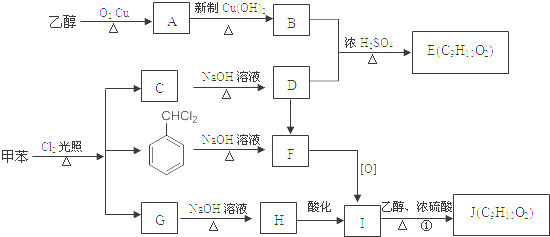

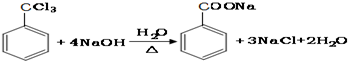 .
.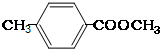 ;②
;②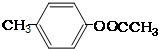 ;③
;③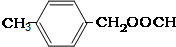 或
或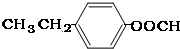 .
.