题目内容
20.甲苯是有机化工生产的基本原料之一.利用乙醇和甲苯为原料,可按下列路线合成分子式均为C9H10O2的有机化工产品E和J.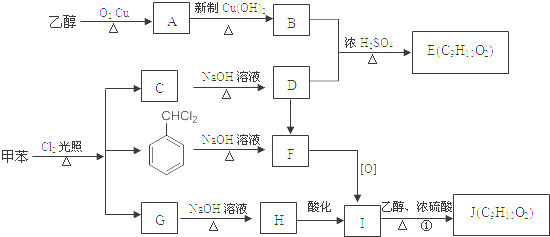
已知:

请回答:
(1)写出下列反应方程式
①A→BCH3CHO+2Ag(NH3)2OH→CH3COONH4+H20+2Ag↓+3NH3.
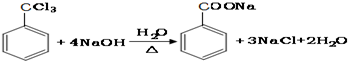
②G→H
 .
.③D→F2C6H5CH2OH+O2$→_{△}^{催化剂}$2C6H5CHO+2H2O.
(2)①的反应类型为氧化反应;F的结构简式为C6H5CHO.
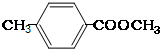
(3)E、J有多种同分异构体,写出符合下列条件的3种同分异构体结构简式.
要求:①与E、J属同类物质②苯环上有两个取代基且苯环上的一氯代物只有两种.
①
 ;②
;②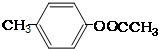 ;③
;③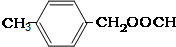 或
或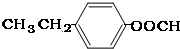 .
.
分析 乙醇被氧气氧化生成A为CH3CHO,乙醛被氧化生成B为CH3COOH,乙酸和D反应生成E,根据乙酸和E的分子式知,D是C6H5CH2OH,则E为CH3COOCH2C6H5,C和氢氧化钠的水溶液发生取代反应生成苯甲醇,则C是C6H5CH2Cl,二氯甲苯和氢氧化钠的水溶液发生取代反应生成F,结合题给信息知,F是C6H5CHO,苯甲醛被氧化生成I为C6H5COOH,G和氢氧化钠的水溶液反应生成H,H酸化生成苯甲酸,则H是C6H5COONa,G是C6H5CH2Cl3,乙醇和苯甲酸反应生成J为C6H5COOCH2CH3,据此答题;
解答 解:乙醇被氧气氧化生成A为CH3CHO,乙醛被氧化生成B为CH3COOH,乙酸和D反应生成E,根据乙酸和E的分子式知,D是C6H5CH2OH,则E为CH3COOCH2C6H5,C和氢氧化钠的水溶液发生取代反应生成苯甲醇,则C是C6H5CH2Cl,二氯甲苯和氢氧化钠的水溶液发生取代反应生成F,结合题给信息知,F是C6H5CHO,苯甲醛被氧化生成I为C6H5COOH,G和氢氧化钠的水溶液反应生成H,H酸化生成苯甲酸,则H是C6H5COONa,G是C6H5CH2Cl3,乙醇和苯甲酸反应生成J为C6H5COOCH2CH3,
(1)①A为乙醛,A→B的反应为A发生银镜反应生成B,反应方程式为CH3CHO+2Ag(NH3)2OH→CH3COONH4+H20+2Ag↓+3NH3,
②G→H的反应为三氯甲苯和氢氧化钠的水溶液发生取代反应生成苯甲酸钠,反应方程式为: ,
,
③D→F的反应为C6H5CH2OH发生催化氧化生成C6H5CHO,反应的方程式为2C6H5CH2OH+O2$→_{△}^{催化剂}$2C6H5CHO+2H2O,
故答案为:CH3CHO+2Ag(NH3)2OH→CH3COONH4+H20+2Ag↓+3NH3; ;2C6H5CH2OH+O2$→_{△}^{催化剂}$2C6H5CHO+2H2O;
;2C6H5CH2OH+O2$→_{△}^{催化剂}$2C6H5CHO+2H2O;
(2)①为醛的氧化,所以反应类型为氧化反应,根据上面的分析可知,F的结构简式为 C6H5CHO,
故答案为:氧化反应; C6H5CHO;
(3)E、J有多种同分异构体,①与E、J属同类物质,说明含有苯环和酯基,②苯环上有两个取代基且苯环上的一氯代物只有两种,说明两个取代基处于对位,符合条件的同分异构体为:① 、②
、② 、③
、③ 或
或 ,
,
故答案为:① 、②
、② 、③
、③ 或
或 .
.
点评 本题考查有机物的推断,涉及反应类型的判断、方程式的书写、同分异构体的确定等知识点,同分异构体的确定是学习的难点,根据含有的官能团结合题给信息进行分析解答,难度较大.

 字词句篇与同步作文达标系列答案
字词句篇与同步作文达标系列答案| A. | FeO | B. | Fe2O3 | C. | CuO | D. | Fe3O4 |
| A. | 17g NH3和18 g H2O中含有的电子数均为10NA | |
| B. | 2 L 1.5 mol•L-1醋酸溶液中含有的CH3COO-数为3NA | |
| C. | 标准状况下,5.6 L Cl2溶解于足量NaOH溶液中,转移的电子数为0.5NA | |
| D. | 恒压密闭容器中充入2 mol NO与1 mol NO2,容器中分子数为3NA |
 二氧化碳是地球温室效应的罪魁祸首,目前人们处理二氧化碳的方法之一是使其与氢气反应合成甲醇.已知氢气、甲醇燃烧的热化学方程式如下:
二氧化碳是地球温室效应的罪魁祸首,目前人们处理二氧化碳的方法之一是使其与氢气反应合成甲醇.已知氢气、甲醇燃烧的热化学方程式如下:①2H2(g)+O2(g)═2H2O(l)△H=-283.0 kJ/mol;
②2CH3OH(1)+3O2(g)═2CO2(g)+4H2O(l)△H=-726.0 kJ/mol.
(1)完成二氧化碳与氢气合成甲醇液体的热化学方程式:CO2(g)+3H2(g)?CH3OH(l)+H2O(l)△H=-61.5kJ/mol
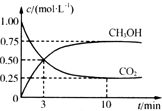
(2)为探究反应原理,现进行如下实验,在体积为1L的密闭容器中,充入1mol CO2和3mol H2,在500℃下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0 kJ/mol测得CO2(g)和CH3OH(l)的浓度随时间的变化如图所示,平衡时CH3OH的体积分数为30%.
(3)已知反应2CH3OH?CH3OCH3(g)+H2O(g)在某温度下的平衡常数为400.此温度下,在密闭容器中加入CH3OH,反应到某时刻测得各组分的浓度如下:
| 物质 | CH3OH | CH3OCH3 | H2O |
| 浓度/(mol/L) | 0.44 | 0.6 | 0.6 |
②若加入CH3OH后,经10min反应达到平衡,该时间内反应速率v(CH3OH)=0.16 mol/(L•min).
(4)甲醇-空气燃料电池是利用稀土金属氧化物作为固体电解质,这种稀土金属氧化物在高温下能传导O2-.
①负极发生的反应是CH3OH-6e-+3O2-=CO2+2H2O;
②在稀土金属氧化物的固体电解质中,O2-的移动方向是A.(填字母)
A.从正极移向负极 B.从负极移向正极 C.从阳极移向阴极 D.从阴极移向阳极.
| A. | 标准状况下,4.48 L水中含有的分子数目为0.2NA | |
| B. | 1 mol•L-1 的CaCl2溶液中,含有氯离子数2NA | |
| C. | 23g Na与足量O2反应转移的电子数为NA | |
| D. | 1mol苯中含有“C=C”的数目为3NA |
| A. | 用氨水吸收足量的SO2气体:2OH-+SO2═SO32-+H2O | |
| B. | NaAlO2溶液中AlO2-的水解:AlO2-+2H2O═Al(OH)3↓+OH- | |
| C. | 加入NaClO将污水中的NH3氧化成N2:3ClO-+2NH3═N2↑+3Cl-+3H2O | |
| D. | NaHCO3溶液中加少量Ba(OH)2溶液:HCO3-+Ba2++OH-═BaCO3↓+H2O |