题目内容
3.下列说法中正确的是( )①钠在空气中燃烧生成白色的氧化钠
②钠投入硫酸铜稀溶液中有红色粉末产生
③过氧化钠可在防毒面具中做供氧剂
④铁丝在氯气中燃烧生成棕褐色的烟
⑤钠、氢气在氯气中燃烧都能产生白烟.
| A. | ①② | B. | ②③ | C. | ③④ | D. | ④⑤ |
分析 钠性质活泼,可与水反应生成氢氧化钠和氢气,与氧气在点燃条件下反应生成淡黄色的过氧化钠,过氧化钠和二氧化碳反应生成氧气,可用于供氧剂,结合氯气的性质解答该题.
解答 解:①钠在空气中燃烧生成淡黄色的过氧化钠,故错误;
②钠投入硫酸铜溶液中,生成氢氧化铜和氢气,故错误;
③过氧化钠可与二氧化碳反应生成氧气,可在防毒面具中做供氧剂,故正确;
④氯气具有强氧化性,铁丝在氯气中燃烧生成棕色的FeCl3,故正确;
⑤氢气在氯气中燃烧产生白雾,故错误,
故选C.
点评 本题综合考查钠、钠的化合物以及氯气的性质与用途,为高频考点,侧重于元素化合物知识的综合理解和运用的考查,难度不大,注意相关基础知识的积累.

练习册系列答案
相关题目
13.下列事实能说明金属甲比金属乙的活动性强的是( )
| A. | 在发生化学反应时,甲原子失电子数比乙原子多 | |
| B. | 甲的阳离子的氧化性比乙离子强 | |
| C. | 甲的氢氧化物的碱性小于乙的氢氧化物的碱性 | |
| D. | 在甲、乙、硫酸组成的原电池中,甲为负极 |
14.设阿伏加德罗常数(NA)的数值为nA,下列说法正确的是( )
| A. | 1 mol Cl2与足量Fe反应,转移的电子数为3NA | |
| B. | 3mol NO2与足量H2O反应,转移的电子数为NA | |
| C. | 0.1mol/L的氢氧化钠溶液中含钠离子数为0.1NA个 | |
| D. | 0.30mol Fe粉与足量水蒸气反应生成的H2分子数为0.40NA |
11.NA为阿伏加德罗常数的值.下列说法正确的是( )
| A. | 17g NH3和18 g H2O中含有的电子数均为10NA | |
| B. | 2 L 1.5 mol•L-1醋酸溶液中含有的CH3COO-数为3NA | |
| C. | 标准状况下,5.6 L Cl2溶解于足量NaOH溶液中,转移的电子数为0.5NA | |
| D. | 恒压密闭容器中充入2 mol NO与1 mol NO2,容器中分子数为3NA |
18.下列关于实验现象的描述中不正确的是( )
| A. | 氢气在氯气中安静燃烧,发出苍白色火焰 | |
| B. | 铁丝在氯气中燃烧,产生棕褐色的烟 | |
| C. | 铜丝在氯气中燃烧,产生棕黄色的烟 | |
| D. | 钠在氯气中燃烧,产生黄色的烟 |
15. 二氧化碳是地球温室效应的罪魁祸首,目前人们处理二氧化碳的方法之一是使其与氢气反应合成甲醇.已知氢气、甲醇燃烧的热化学方程式如下:
二氧化碳是地球温室效应的罪魁祸首,目前人们处理二氧化碳的方法之一是使其与氢气反应合成甲醇.已知氢气、甲醇燃烧的热化学方程式如下:
①2H2(g)+O2(g)═2H2O(l)△H=-283.0 kJ/mol;
②2CH3OH(1)+3O2(g)═2CO2(g)+4H2O(l)△H=-726.0 kJ/mol.
(1)完成二氧化碳与氢气合成甲醇液体的热化学方程式:CO2(g)+3H2(g)?CH3OH(l)+H2O(l)△H=-61.5kJ/mol
(2)为探究反应原理,现进行如下实验,在体积为1L的密闭容器中,充入1mol CO2和3mol H2,在500℃下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0 kJ/mol测得CO2(g)和CH3OH(l)的浓度随时间的变化如图所示,平衡时CH3OH的体积分数为30%.
(3)已知反应2CH3OH?CH3OCH3(g)+H2O(g)在某温度下的平衡常数为400.此温度下,在密闭容器中加入CH3OH,反应到某时刻测得各组分的浓度如下:
①比较此时正、逆反应速率的大小:v正>(填“>”、“<“或“=”)v逆;
②若加入CH3OH后,经10min反应达到平衡,该时间内反应速率v(CH3OH)=0.16 mol/(L•min).
(4)甲醇-空气燃料电池是利用稀土金属氧化物作为固体电解质,这种稀土金属氧化物在高温下能传导O2-.
①负极发生的反应是CH3OH-6e-+3O2-=CO2+2H2O;
②在稀土金属氧化物的固体电解质中,O2-的移动方向是A.(填字母)
A.从正极移向负极 B.从负极移向正极 C.从阳极移向阴极 D.从阴极移向阳极.
 二氧化碳是地球温室效应的罪魁祸首,目前人们处理二氧化碳的方法之一是使其与氢气反应合成甲醇.已知氢气、甲醇燃烧的热化学方程式如下:
二氧化碳是地球温室效应的罪魁祸首,目前人们处理二氧化碳的方法之一是使其与氢气反应合成甲醇.已知氢气、甲醇燃烧的热化学方程式如下:①2H2(g)+O2(g)═2H2O(l)△H=-283.0 kJ/mol;
②2CH3OH(1)+3O2(g)═2CO2(g)+4H2O(l)△H=-726.0 kJ/mol.
(1)完成二氧化碳与氢气合成甲醇液体的热化学方程式:CO2(g)+3H2(g)?CH3OH(l)+H2O(l)△H=-61.5kJ/mol
(2)为探究反应原理,现进行如下实验,在体积为1L的密闭容器中,充入1mol CO2和3mol H2,在500℃下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0 kJ/mol测得CO2(g)和CH3OH(l)的浓度随时间的变化如图所示,平衡时CH3OH的体积分数为30%.
(3)已知反应2CH3OH?CH3OCH3(g)+H2O(g)在某温度下的平衡常数为400.此温度下,在密闭容器中加入CH3OH,反应到某时刻测得各组分的浓度如下:
| 物质 | CH3OH | CH3OCH3 | H2O |
| 浓度/(mol/L) | 0.44 | 0.6 | 0.6 |
②若加入CH3OH后,经10min反应达到平衡,该时间内反应速率v(CH3OH)=0.16 mol/(L•min).
(4)甲醇-空气燃料电池是利用稀土金属氧化物作为固体电解质,这种稀土金属氧化物在高温下能传导O2-.
①负极发生的反应是CH3OH-6e-+3O2-=CO2+2H2O;
②在稀土金属氧化物的固体电解质中,O2-的移动方向是A.(填字母)
A.从正极移向负极 B.从负极移向正极 C.从阳极移向阴极 D.从阴极移向阳极.
12.用NA表示阿伏加德罗常数的值.下列判断正确的是( )
| A. | 标准状况下,4.48 L水中含有的分子数目为0.2NA | |
| B. | 1 mol•L-1 的CaCl2溶液中,含有氯离子数2NA | |
| C. | 23g Na与足量O2反应转移的电子数为NA | |
| D. | 1mol苯中含有“C=C”的数目为3NA |
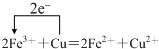 .
.