题目内容
16.铜是与人类关系非常密切的常见金属.Ⅰ.已知常温下,在溶液中Cu2+稳定,Cu+易在酸性条件下发生反应:2Cu+=Cu2++Cu.
(1)CuH中H元素化合价为-1.
(2)目前制备纳米级Cu2O的一种方法:在氢氧化铜悬浊液中滴入N2H4•H2O水溶液,充分反应后即可得到Cu2O,同时产生无色无味的气体.上述制备过程中总反应的化学方程式为4Cu(OH)2+N2H4•H2O═2Cu2O+N2↑+7H2O.
(3)一定条件下,在CuSO4中加入NH4H反应生成氢化亚铜(CuH).将CuH溶解在足量稀硫酸中,当产生6.72L H2(标准状况下)时,参加反应的硫酸的物质的量为0.15mol.
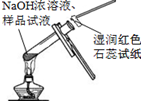
Ⅱ.孔雀石呈绿色,是一种名贵的宝石.其主要成分是xCu(OH)2•yCuCO3.某兴趣小组为探究孔雀石组成,利用下图所示的装置(夹持仪器省略)进行实验:
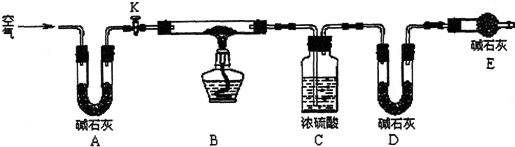
步骤1:检查装置的气密性,将研细的样品置于硬质玻璃管中.
步骤2:称量相关装置的质量,打开活塞K,鼓入空气,一段时间后关闭.
步骤3:加热装置B直至装置C中无气泡产生.
步骤4:打开K1,继续通一段时间空气至装置冷却.
步骤5:冷却至室温,称量相关装置的质量.
(1)请补充步骤4操作内容:打开K1,继续通一段时间空气至装置冷却.
(2)若无装置E,则实验测定的x/y的值将偏小(选填“偏大”、“偏小”或
“无影响”).
(3)某同学在实验过程中采集了如下数据:
A.反应前硬质玻璃管与样品的质量163.8g
B.反应后硬质玻璃管中残留固体质量20g
C.装置C实验后增重2.25g
D.装置D实验后增重5.5g
为测定x/y的值,你认为可以选用上述所采集数据中的BC、BD、CD (写出所有组合的字母代号)任一组即可进行计算,并根据你的计算结果,写出孔雀石组成的化学式Cu(OH)2•CuCO3.
分析 Ⅰ.(1)由题意可知,CuH是氢化亚铜,据化合物中化合价代数和等于0判断;
(2)根据“在新制Cu(OH)2浊液中滴入N2H4•H2O水溶液,同时产生无色无味的气体”判断反应物、生成物,然后写出反应的化学方程式;
(3)据CuH与过量稀硫酸反应的离子方程式计算.
Ⅱ.(1)依据实验步骤和目的分析,步骤4是反应完毕后,需要继续通空气,让装置冷却;
(2)装置E的作用是防止空气中的二氧化碳和水蒸气进入D装置;
(3)根据化学方程式找出与x、y有关的物质质量,对比分析,碱式碳酸铜分解的化学方程xCu(OH)2•yCuCO3$\frac{\underline{\;\;△\;\;}}{\;}$(x+y)CuO+xH2O+yCO2↑要测定x/y,可以测定生成的水和二氧化碳的质量,即测定C装置增重的质量和D装置增重的质量或BC、BD装置质量计算判断;根据计算结果写出该样品组成的化学式.
解答 解:Ⅰ.(1)CuH是氢化亚铜,据化合物中化合价代数和等于0可知,H为-1价,故答案为:-1;
(2)在新制Cu(OH)2浊液中滴入N2H4•H2O水溶液,产生无色无味的气体,根据化合价变化,铜离子化合价降低被还原,能够被氧化生成无色无味的气体可能为N、O元素,由于氧气具有氧化性,不可能生成氧化亚铜,所以该气体只能是氮气,根据化合价升降法配平,反应的化学方程式为:4Cu(OH)2+N2H4•H2O═2Cu2O+N2↑+7H2O,
故答案为:4Cu(OH)2+N2H4•H2O═2Cu2O+N2↑+7H2O;
(3)CuH与过量稀硫酸反应的离子方程式为2CuH+2H+=Cu+Cu2++H2↑,生成$\frac{6.72L}{22.4L/mol}$=0.3mol氢气时,参加反应的氢离子物质的量为0.3mol,所以硫酸的物质的量为0.15mol,
故答案为:0.15mol;
Ⅱ.(1)步骤4反应完毕后,需要继续通空气,让装置冷却,所以步骤4为:打开K1,继续通一段时间空气至装置冷却,
故答案为:打开K1,继续通一段时间空气至装置冷却;
(2)装置E的作用是防止空气中的二氧化碳和水蒸气进入D装置,D装置是吸收生成的二氧化碳的,C装置是吸收生成的水的,如果没有装置E,会使D装置质量增重偏大,即生成的二氧化碳质量偏大,则$\frac{x}{y}$的值会偏小
故答案为:偏小;
(3)碱式碳酸铜分解的化学方程xCu(OH)2•yCuCO3$\frac{\underline{\;\;△\;\;}}{\;}$(x+y)CuO+xH2O+yCO2↑要测定x/y的值,可以测定生成的水和二氧化碳的质量,即测定C装置增重的质量和D装置增重的质量,故可选CD,
xCu(OH)2•yCuCO3$\frac{\underline{\;\;△\;\;}}{\;}$(x+y)CuO+xH2O+yCO2↑
18x 44y
2.25g 5.5g
则:$\frac{18x}{2.25g}$=$\frac{44y}{5.5g}$,解得:$\frac{x}{y}$=1:1;
若测出反应后玻璃管中样品的质量以及装置C增重的质量,即已知方程式中氧化铜和水的质量关系,可求出$\frac{x}{y}$的值,故可选BC,
xCu(OH)2•yCuCO3$\frac{\underline{\;\;△\;\;}}{\;}$(x+y)CuO+xH2O+yCO2↑
(x+y)×80 18x
20g 2.25g
则:$\frac{(x+y)×80}{20g}$=$\frac{18x}{2.25g}$,解得:$\frac{x}{y}$=1:1;
同样若已知反应后玻璃管中样品的质量以及装置C增重的质量,即已知方程式中氧化铜和二氧化碳的质量关系,可求出$\frac{x}{y}$的值.故可选BD,
xCu(OH)2•yCuCO3$\frac{\underline{\;\;△\;\;}}{\;}$(x+y)CuO+xH2O+yCO2↑
(x+y)×80 44y
20g 5.5g
则:$\frac{(x+y)×80}{20g}$=$\frac{44y}{5.5g}$,解得$\frac{x}{y}$=1:1;
根据以上计算结果可知该样品组成的化学式为:Cu(OH)2•CuCO3,
故答案为:BC、BD、CD;Cu(OH)2•CuCO3.
点评 本题考查了化合价计算、离子方程式书写以及据化学方程式的计算、物质组成的测量方法,题目难度中等,明确浓硫酸增重的质量是生成的水的质量、碱石灰增重的质量是生成的二氧化碳的质量为解答关键,试题侧重考查学生的分析、理解能力及化学计算、化学实验能力.

| A. | 铝制、铁制容器常温下可以盛放浓硝酸 | |
| B. | 久置的浓硝酸溶液呈黄色 | |
| C. | 金属铁与硝酸溶液反应能生成亚铁盐 | |
| D. | 浓硫酸是一种干燥剂,能够干燥氨气、氧气等气体 |
| A. | 6种 | B. | 5种 | C. | 4种 | D. | 3种 |
| A. | 17g NH3和18 g H2O中含有的电子数均为10NA | |
| B. | 2 L 1.5 mol•L-1醋酸溶液中含有的CH3COO-数为3NA | |
| C. | 标准状况下,5.6 L Cl2溶解于足量NaOH溶液中,转移的电子数为0.5NA | |
| D. | 恒压密闭容器中充入2 mol NO与1 mol NO2,容器中分子数为3NA |
①少用煤作燃料;②把工厂的烟囱造高;③燃料脱硫;④在已酸化的土壤中加石灰;⑤开发新能源.
| A. | ①②③ | B. | ②③④ | C. | ①③⑤ | D. | ③④⑤ |