题目内容
6.化学平衡常数(K)、电离常数(Ka,Kb)、溶度积常数(Ksp)等常数是表示判断物质性质的重要常数.下列关于这些常数的说法.不正确的是( )| A. | 化学平衡常数的大小只与温度有关,与浓度、压强、催化剂无关 | |
| B. | 相同温度时,Ka(HCN)<Ka(CH3COOH),说明物质的量浓度相同时,氢氰酸的酸性比醋酸弱 | |
| C. | 向氯化钡溶液中加入同浓度的碳酸钠和硫酸钠溶液,先产生BaSO4沉淀,则Ksp(BaSO4)>Ksp(BaCO3) | |
| D. | 当温度升高时,Ka(CH3COOH)变大 |
分析 A.化学平衡常数只与温度有关;
B.相同温度时,一元酸的电离平衡常数越大,该酸的电离程度越大,其酸性越强;
C.溶度积常数小的物质先生成沉淀;
D.弱电解质的电离是吸热反应,升高温度促进弱电解质的电离.
解答 解:A.化学平衡常数只与温度有关,温度影响平衡移动,压强可能影响平衡移动,催化剂不影响平衡移动,但平衡常数与浓度、压强及催化剂无关,故A正确;
B.相同温度时,一元酸的电离平衡常数越大,该酸的电离程度越大,其酸性越强,所以相同温度时,Ka(HCN)<Ka(CH3COOH),说明物质的量浓度相同时,氢氰酸的酸性比醋酸弱,故B正确;
C.溶度积常数小的物质先生成沉淀,向氯化钡溶液中加入同浓度的碳酸钠和硫酸钠溶液,先产生BaSO4沉淀,则Ksp(BaSO4)<Ksp(BaCO3),故C错误;
D.弱电解质的电离是吸热反应,升高温度促进弱电解质的电离,醋酸是弱电解质,升高温度促进醋酸电离,则醋酸电离平衡常数增大,故D正确;
故选C.
点评 本题考查平衡常数有关知识,为高频考点,明确平衡常数内涵是解本题关键,平衡常数只与温度有关,与其它因素无关,知道弱酸电离平衡常数与电离程度关系,题目难度不大.

练习册系列答案
 百分学生作业本题练王系列答案
百分学生作业本题练王系列答案 互动课堂系列答案
互动课堂系列答案
相关题目
17.下列表示对应化学反应的离子方程式正确的是( )
| A. | 加入NaClO将污水中的NH3氧化成N2:3ClO-+2NH3═N2↑+3Cl-+3H2O | |
| B. | 向稀HNO3中滴加Na2SO3溶液:SO32-+2H+═SO2↑+H2O | |
| C. | NaAlO2溶液中AlO2-的水解:AlO2-+2H2O═Al(OH)3↓+OH- | |
| D. | 向Na2SiO3溶液中通入过量SO2:SiO32-+SO2+H2O═H2SiO3↓+SO32- |
14.如图所示有机物的一氯取代物有(不含立体异构)( )


| A. | 5种 | B. | 6种 | C. | 7种 | D. | 8种 |
1.化学与科学、技术、社会和环境密切相关.下列有关说法正确的是( )
| A. | 煤的气化和液化是物理变化,煤的干馏是化学变化 | |
| B. | 乙醇、过氧化氢、次氯酸钠等消毒液均可以将病毒氧化而达到消毒的目的 | |
| C. | 氢氧燃料电池发电,比氢气直接在空气中燃烧发电能量转换率高 | |
| D. | 合成氨反应N2(g)+3H2(g)?2NH3(g) OH<O,加入催化剂能加快反应速率并提高转化率 |
18.下列实验方案正确的是( )
| A. | 分别加入Na0H溶液并加热,鉴别地沟油(餐饮废弃油)和矿物油(汽油、煤油等) | |
| B. | 为检验酸性溶液中的Cl-和SO42-,先加硝酸银溶液,滤去沉淀后加硝酸钡溶液 | |
| C. | 为探究温度对化学反应速率的影响时,先将硫代硫酸钠与硫酸两种溶液混合后再用水浴加热 | |
| D. | 往含有FeBr2和FeI2的混合溶液中通足量的氯气,然后把溶液蒸干、灼烧,得到FeCl3固体 |
10.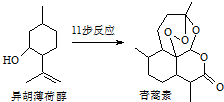 2015年诺贝尔生理学、医学奖的一半授予我国药物化学家屠吆吆,以表彰她发明抗疟疾新药青蒿素和双氢青蒿素.以异胡薄荷醇为起始原料是人工全合成青蒿素的途径之一(如图).下列说法正确的是( )
2015年诺贝尔生理学、医学奖的一半授予我国药物化学家屠吆吆,以表彰她发明抗疟疾新药青蒿素和双氢青蒿素.以异胡薄荷醇为起始原料是人工全合成青蒿素的途径之一(如图).下列说法正确的是( )
 2015年诺贝尔生理学、医学奖的一半授予我国药物化学家屠吆吆,以表彰她发明抗疟疾新药青蒿素和双氢青蒿素.以异胡薄荷醇为起始原料是人工全合成青蒿素的途径之一(如图).下列说法正确的是( )
2015年诺贝尔生理学、医学奖的一半授予我国药物化学家屠吆吆,以表彰她发明抗疟疾新药青蒿素和双氢青蒿素.以异胡薄荷醇为起始原料是人工全合成青蒿素的途径之一(如图).下列说法正确的是( )| A. | 异胡薄荷醇的分子式为C10H12O | |
| B. | 青蒿素提取时可以通过加热或加碱溶解的方法提高其浸取率 | |
| C. | 青蒿素易溶于水,而难溶于有机溶剂 | |
| D. | 异胡薄荷醇可发生消去反应 |
 2NH3,向X的水溶液中滴入酚酞溶液,会观察到溶液变红色
2NH3,向X的水溶液中滴入酚酞溶液,会观察到溶液变红色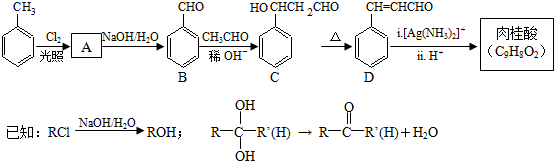
 .
.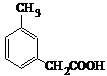 、
、 .
.