题目内容
11.用邻苯二甲酸氢钾(KHC8H4O4)标定浓度为0.1mol•L-1的NaOH溶液时,若取NaOH25.00mL,这时至少应称取邻苯二甲酸氢钾多少克?分析 邻苯二甲酸氢钾(KHC8H4O4)标定浓度为0.1mol•L-1的NaOH溶液时,反应如下:KHC8H4O4+NaOH=KNaC8H4O4+H2O,根据反应方程式,结合n=cV和m=nM进行计算求解.
解答 解:邻苯二甲酸氢钾(KHC8H4O4)标定浓度为0.1mol•L-1的NaOH溶液时,反应如下:KHC8H4O4+NaOH=KNaC8H4O4+H2O,n(KHC8H4O4)=n(NaOH)=0.1×25×10-3mol=2.5×10-3mol,所以邻苯二甲酸氢钾:2.5×10-3mol×204.2g/mol=0.51g,答:苯二甲酸氢钾的质量为:0.51g.
点评 本题考查了有关化学方程式的计算以及物质的量的相关计算,属于基础型题目,难度不大.

练习册系列答案
相关题目
1.下列说法中正确的是( )
| A. | pH小于7的雨水称为酸雨 | |
| B. | CO、NO、NO2都是大气污染气体,在空气中都能稳定存在 | |
| C. | O3可用于游泳池的杀菌消毒 | |
| D. | 黄铜是纯铜,青铜是合金 |
2.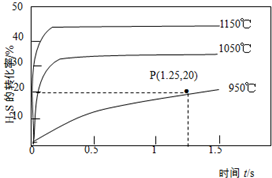 硫化氢分解制取氢气和硫磺的原理为:2H2S(g)?S2(g)+2H2(g),在2.0L恒容密闭容器中充入0.1molH2S,不同温度下测得H2S的转化率与时间的关系如图所示.下列说法正确的是( )
硫化氢分解制取氢气和硫磺的原理为:2H2S(g)?S2(g)+2H2(g),在2.0L恒容密闭容器中充入0.1molH2S,不同温度下测得H2S的转化率与时间的关系如图所示.下列说法正确的是( )
 硫化氢分解制取氢气和硫磺的原理为:2H2S(g)?S2(g)+2H2(g),在2.0L恒容密闭容器中充入0.1molH2S,不同温度下测得H2S的转化率与时间的关系如图所示.下列说法正确的是( )
硫化氢分解制取氢气和硫磺的原理为:2H2S(g)?S2(g)+2H2(g),在2.0L恒容密闭容器中充入0.1molH2S,不同温度下测得H2S的转化率与时间的关系如图所示.下列说法正确的是( )| A. | 图中P点:v(正)>v(逆) | |
| B. | 正反应为放热反应 | |
| C. | 950℃时,0~1.25s生成H2的平均反应速率为:0.008mol•L-1•s-1 | |
| D. | 950℃时,该反应的平衡常数的值小于3.125×10-4 |
6.化学平衡常数(K)、电离常数(Ka,Kb)、溶度积常数(Ksp)等常数是表示判断物质性质的重要常数.下列关于这些常数的说法.不正确的是( )
| A. | 化学平衡常数的大小只与温度有关,与浓度、压强、催化剂无关 | |
| B. | 相同温度时,Ka(HCN)<Ka(CH3COOH),说明物质的量浓度相同时,氢氰酸的酸性比醋酸弱 | |
| C. | 向氯化钡溶液中加入同浓度的碳酸钠和硫酸钠溶液,先产生BaSO4沉淀,则Ksp(BaSO4)>Ksp(BaCO3) | |
| D. | 当温度升高时,Ka(CH3COOH)变大 |
16.一定条件下,可逆反应的平衡常数可以用平衡浓度计算,也可以用平衡分压代替平衡浓度计算分压=总压×物质的量分数.在恒温恒压条件下,总压不变,用平衡分压计算平衡常数更方便.下列说法不正确的是( )
| A. | 对于C2H4(g)+H2O(g)?C2H5OH(g),在一定条件下达到平衡状态时,体系的总压强为P,其中C2H4(g)、H2O(g)、C2H5OH(g)均为1mol,则用分压表示的平衡常数Kp=$\frac{3}{P}$ | |
| B. | 恒温恒压下,在一容积可变的容器中,反应2A(g)+B(g)?2C(g)达到平衡时,A、B和C的位置的量分别为4mol、2mol和4mol,若此时A、B和C均增加1mol,平衡正向移动 | |
| C. | 恒温恒压下,在一容积可变的容器中,N2(g)+3H2(g)?2NH3(g)达到平衡状态时,N2、H2、NH3各1mol,若此时再充入3molN2,则平衡正向移动 | |
| D. | 对于一定条件下的某一可逆反应,用平衡浓度表示的平衡常数和平衡分压表示的平衡常数,其数值不同,但意义相同,都只与温度有关 |
3.下列化学用语中,用来表示石油裂解产物丙烯的是( )
| A. | 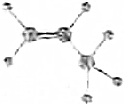 | B. | C3H6 | ||
| C. | 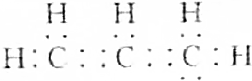 | D. | CH2═CHCH3 |
16.下列各组离子能够大量共存的是( )
| A. | pH=1的溶液中:Al3+、Mg2+、Cl-、SO42- | |
| B. | 使pH试纸显蓝色的溶液中:Cu2+、Fe2+、NO3-、SO42- | |
| C. | 滴入甲基橙指示剂呈红色的溶液中:K+、NH4+、CO32-、NO3- | |
| D. | 水电离出的c(H+)=1×10-13mol•L-1的溶液中:K+、NH4+、HCO3-、Cl- |

 +
+ $\stackrel{△}{→}$
$\stackrel{△}{→}$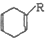
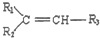 $→_{△}^{KMnO_{4}/H+}$
$→_{△}^{KMnO_{4}/H+}$ +R3-COOH
+R3-COOH ,D的核磁共振氢谱共有3组峰.
,D的核磁共振氢谱共有3组峰.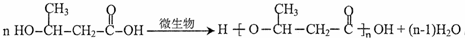 .
. (一种类似有机玻璃的塑料).第一步反应的化学方程式是
(一种类似有机玻璃的塑料).第一步反应的化学方程式是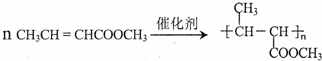 .
.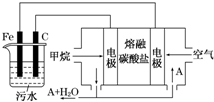 电浮选凝聚法是工业上采用的一种污水处理方法:保持污水的pH在5.0~6.0之间,通过电解生成Fe(OH)3沉淀.Fe(OH)3有吸附性,可吸附污物而沉积下来,具有净化水的作用.阴极产生的气泡把污水中悬浮物带到水面形成浮渣层,刮去(或撇掉)浮渣层,即起到了浮选净化的作用.某科研小组用电浮选凝聚法处理污水,设计装置示意图,如图所示.
电浮选凝聚法是工业上采用的一种污水处理方法:保持污水的pH在5.0~6.0之间,通过电解生成Fe(OH)3沉淀.Fe(OH)3有吸附性,可吸附污物而沉积下来,具有净化水的作用.阴极产生的气泡把污水中悬浮物带到水面形成浮渣层,刮去(或撇掉)浮渣层,即起到了浮选净化的作用.某科研小组用电浮选凝聚法处理污水,设计装置示意图,如图所示.