题目内容
20.pH=5的NH4Cl溶液由水电离出来的H+离子浓度为a mol•L-1,pH=5的HCOOH溶液由水电离出来的H+离子浓度为b mol•L-1,下列a和b的关系正确的是( )| A. | a=b | B. | a=10-4b | C. | a=104b | D. | 无法确定 |
分析 水电离生成氢离子和氢氧根离子,所以酸或碱抑制水电离,含有弱离子的盐水解而促进水电离,据Kw=c(H+)•c(OH-)计算解答.
解答 解:pH=5的醋酸溶液中,水的电离被抑制,氢氧根全部来自于水的电离,而水电离出的氢离子和氢氧根浓度相同,故由水电离出的c(H+)=10-9mol/L=b,pH=5的NH4Cl溶液,水的电离被促进,溶液中的氢离子即为水电离出的全部氢离子,即其中由水电离出的c(H+)=10-5mol/L=a,即a=104b.
故选C.
点评 本题考查了弱电解质的电离及盐类水解,根据水电离出的离子确定物质对水电离是抑制还是促进,注意酸溶液中氢离子不等于水电离出的氢离子,为易错点.

练习册系列答案
相关题目
10.下列物质中,既含有共价键又含有离子键的是( )
| A. | HF | B. | NaCl | C. | HCl | D. | KOH |
8.将32g CuO热到900℃,CuO部分分解为Cu2O,最后固体质量为31.2g.则未分解的CuO与分解的CuO的物质的量之比为( )
| A. | 2:1 | B. | 1:2 | C. | 1:3 | D. | 3:1 |
15.溶液体积和pH都相同的一元强酸X与一元弱酸溶液Y,已知弱酸的电离度为0.5%,则X和Y溶液分别中和相同浓度的NaOH溶液时,所需Y溶液的体积是X溶液的( )
| A. | 20倍 | B. | 100倍 | C. | 200倍 | D. | 500倍 |
5.物质的量浓度相同(0.2mol/L)的弱酸HX与NaX溶液等体积混合后,溶液中微粒浓度关系错误的是( )
| A. | c(Na+)+c(H+)=c(X-)+c(OH-) | |
| B. | c(HX)+c(X-)=c(Na+) | |
| C. | 若混合液呈酸性,则c(X-)>c(Na+)>c(HX)>c(H+)>c(OH-) | |
| D. | 若混合液呈酸性,则c(Na+)>c(HX)>c(X-)>c(OH-)>c(H+) |
9.下列叙述正确的是( )
| A. | 含金属元素的离子不一定是阳离子 | |
| B. | 一种元素可形成多种离子,但只能是带同种电荷的离子 | |
| C. | 由同种元素组成的物质肯定属于纯净物 | |
| D. | 具有相同质子数的粒子都属于同种元素 |
10.下列有关说法正确的是( )
| A. | 常温下,0.1 mol•L-1Na2S溶液中存在:c(OH-)=c(H+)+c(HS-)+2c(H2S) | |
| B. | 常温下,0.1 mol•L-1HA溶液与0.1 mol•L-1 NaOH溶液正好完全反应时,溶液中一定存在:c(Na+)=c(A-)>c(OH-)=c(H+) | |
| C. | 常温下,向0.1 mol•L-1CH3COOH 溶液加水稀释,当溶液的pH从3.0升到4.0时,溶液中的$\frac{c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)}$值增大到原来的10倍 | |
| D. | 常温下,pH=7的CH3COONa和CH3COOH混合溶液中c(Na+)=0.1 mol•L-1:c(Na+)=c(CH3COOH)>c(CH3COO-)>c(H+)=c(OH-) |
 CH3COOCH2CH3+H2O.
CH3COOCH2CH3+H2O.
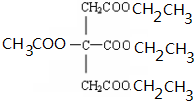 +NaOH$\stackrel{△}{→}$CH3COONa+
+NaOH$\stackrel{△}{→}$CH3COONa+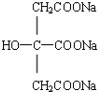 +3CH3CH2OH+3H2O.
+3CH3CH2OH+3H2O. ,E分子在浓硫酸、加热条件下可生成分子甲,其分子式为C6H6O6,则符合上述条件甲分子有2种.
,E分子在浓硫酸、加热条件下可生成分子甲,其分子式为C6H6O6,则符合上述条件甲分子有2种.