题目内容
8.将32g CuO热到900℃,CuO部分分解为Cu2O,最后固体质量为31.2g.则未分解的CuO与分解的CuO的物质的量之比为( )| A. | 2:1 | B. | 1:2 | C. | 1:3 | D. | 3:1 |
分析 4CuO$\frac{\underline{\;\;△\;\;}}{\;}$2Cu2O+O2↑根据差量法可得氧气的质量,由n=$\frac{m}{M}$可得氧气的物质的量,根据物质的量的变化比等于化学计量数之比得出反应掉的CuO的物质的量和生成的
Cu2O的物质的量;16g CuO的物质的量减去反应掉的CuO的物质的量等于剩余固体中CuO的物质的量.
解答 解:32g CuO的物质的量n(CuO)=$\frac{32g}{80g/mol}$=0.4mol,4CuO$\frac{\underline{\;\;△\;\;}}{\;}$2Cu2O+O2↑,
根据差量法可得氧气的质量m(O2)=32g-31.2g=0.8g,n(O2)=$\frac{0.8g}{32g/mol}$=0.025mol,
则反应掉的CuO的物质的量n(CuO)=4×0.025mol=0.1mol,
生成的Cu2O的物质的量n(Cu2O)=2×0.025mol=0.05mol,
固体中剩余的CuO的物质的量=n(CuO)-n(CuO)′=0.4mol-0.1mol=0.3mol,
则剩余固体中CuO和分解的CuO的物质的量之比为0.3mol:0.1mol=3:1.
故选D.
点评 本题考查化学方程式的有关计算,题目难度中等,反应前后的质量差为生成的氧气的质量是解题的突破口,本题锻炼了学生的思维能力和计算能力.

练习册系列答案
相关题目
5.下列说法正确的是( )
| A. | 16gO2所含的分子数为6.02×1023个 | |
| B. | 0.5molH2SO4含有的原子数目为3.5NA | |
| C. | 18gH2O中原子的物质的量为1mol | |
| D. | 22g物质A中含有分子数为3.01×1023,则A的摩尔质量为44g |
16.H2和 I2在一定条件下能发生反应:H2(g)+I2(g)?2HI(g)△H=-a kJ/mol.已知:

(a、b、c 均大于零).下列说法正确的是( )

(a、b、c 均大于零).下列说法正确的是( )
| A. | H2、I2和 HI 分子中的化学键都是非极性共价键 | |
| B. | 断开 2 mol HI 分子中的化学键所需能量约为(c+b+a) kJ | |
| C. | 相同条件下,1 mol H2(g)和 1mol I2(g)总能量小于 2 mol HI (g)的总能量 | |
| D. | 向密闭容器中加入 2 mol H2(g)和 2 mol I2(g),充分反应后放出的热量为 2a kJ |
3.用2KMnO4+16HCl═2KCl+2MnCl2+5Cl2↑+8H2O反应制取Cl2,被氧化的HCl和未被氧化的HCl的质量之比为( )
| A. | 1:8 | B. | 2:5 | C. | 5:2 | D. | 5:3 |
20.pH=5的NH4Cl溶液由水电离出来的H+离子浓度为a mol•L-1,pH=5的HCOOH溶液由水电离出来的H+离子浓度为b mol•L-1,下列a和b的关系正确的是( )
| A. | a=b | B. | a=10-4b | C. | a=104b | D. | 无法确定 |
17.常温下,下列溶液中的微粒浓度关系正确的是( )
| A. | pH=8.3的NaHCO3溶液:c(Na+)>c(HCO3-)>c(CO32-)>c(H2CO3) | |
| B. | 0.1mol•L-1的Na2CO3溶液:c(OH-)=c(H+)+c(HCO3-)+c(CO32-) | |
| C. | 向0.2mol•L-1NaHCO3溶液中加入等体积0.1mol•L-1NaOH溶液:c(Na+)+c(H+)=c(HCO3-)+2c(CO32-) | |
| D. | 常温下,CH3COOH)和CH3COONa混合溶液【PH=7,c(Na+)=0.1mol•L-1】:c(CH3COO-)=0.1mol•L-1 |
18.下列措施肯定能使化学反应速率增大的是( )
| A. | 增加反应物的量 | B. | 增大反应体系的压强 | ||
| C. | 降低反应体系的温度 | D. | 使用适宜的催化剂 |
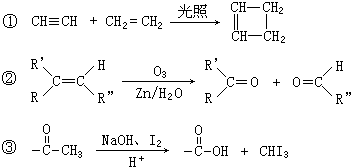
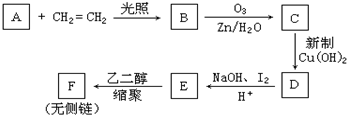
 ,CCH3COCH2CH2CHO,DCH3COCH2CH2COOH,F
,CCH3COCH2CH2CHO,DCH3COCH2CH2COOH,F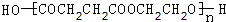 .
.