题目内容
某兴趣小组的同学在学习完Mg与CO2的反应后,预测金属钠也能在CO2中燃烧,为了确定钠在CO2中燃烧的产物,该小组成员设计了下列装置进行实验探究.

已知:PdCl2能被CO还原得到黑色的Pd,反应方程式如下:PdCl2+CO+H2O═Pd↓(黑色)+2HCl+CO2
请回答下列问题:
(1)如果将实验室中用稀盐酸与石灰石反应制备的CO2用于该实验探究,那么上述实验装置中,装置2和装置3中分别盛放的试剂为 和 .
(2)为了使制备CO2的反应能“随开随用,随关随停”,上图中虚线方框内可以选用以下 装置(填字母代号).
(3)检查装置的气密性完好并装好药品后,打开虚线方框中装置的开关,待装置5中出现 的现象时,再点燃酒精灯,这步操作的目的是 .
(4)该兴趣小组的同学在实验前做了以下讨论:
①若装置6中有黑色沉淀生成,装置4中残留固体(只有一种物质)加盐酸后产生能使澄清石灰水变浑浊的气体,则钠与CO2反应的化学方程式为 .
②若装置6中无明显现象,装置4中残留固体(有两种物质)加盐酸后也产生能使澄清石灰水变浑浊的气体,则钠与CO2反应的化学方程式为 .
(5)指导老师认为,不仅要检验残留固体中是否有碳酸钠,还要检验其中是否有氧化钠和碳.当确认钠充分反应后,请你设计一个简单实验,验证装置4中的残留固体中是否含有Na2CO3、Na2O和C(试剂任选).(下表可以不填满,也可以增补)
操作步骤
现象和结论
(1)取少量残留固体
(2)
(3)
…

已知:PdCl2能被CO还原得到黑色的Pd,反应方程式如下:PdCl2+CO+H2O═Pd↓(黑色)+2HCl+CO2
请回答下列问题:
(1)如果将实验室中用稀盐酸与石灰石反应制备的CO2用于该实验探究,那么上述实验装置中,装置2和装置3中分别盛放的试剂为
(2)为了使制备CO2的反应能“随开随用,随关随停”,上图中虚线方框内可以选用以下
(3)检查装置的气密性完好并装好药品后,打开虚线方框中装置的开关,待装置5中出现
(4)该兴趣小组的同学在实验前做了以下讨论:
①若装置6中有黑色沉淀生成,装置4中残留固体(只有一种物质)加盐酸后产生能使澄清石灰水变浑浊的气体,则钠与CO2反应的化学方程式为
②若装置6中无明显现象,装置4中残留固体(有两种物质)加盐酸后也产生能使澄清石灰水变浑浊的气体,则钠与CO2反应的化学方程式为
(5)指导老师认为,不仅要检验残留固体中是否有碳酸钠,还要检验其中是否有氧化钠和碳.当确认钠充分反应后,请你设计一个简单实验,验证装置4中的残留固体中是否含有Na2CO3、Na2O和C(试剂任选).(下表可以不填满,也可以增补)
操作步骤
现象和结论
(1)取少量残留固体
(2)
(3)
…
考点:性质实验方案的设计
专题:实验设计题
分析:(1)由实验方案图可知装置2是除去二氧化碳中的HCl,应用饱和的碳酸氢钠溶液,装置3是除去二氧化碳中的水蒸气,应用浓硫酸溶液;
(2)制取二氧化碳时,为了使制气过程具有“随开随用,随关随停”的特点,应该选用能够可以固、液药品分开的装置;
(3)由实验方案图可知,1为二氧化碳发生装置,4为二氧化碳与钠反应装置,加入4装置的二氧化碳应干燥,没有其它,故装置2是除去二氧化碳其它中的HCl,应用饱和的碳酸氢钠溶液,3为干燥装置,吸收水蒸气.反应需要排尽装置内的空气,当5装置中产生白色沉淀,说明空气中的二氧化碳排尽,再加热4处的酒精灯发生反应;
(4)①由题意可知,装置4中的残留固体(只有一种物质)加盐酸有能使石灰水变浑浊的气体放出,说明生成碳酸钠,装置6中有黑色沉淀,说明PdCl2溶液能被CO还原得到黑色的Pd,所以反应物为碳酸钠和CO;
②装置4中残留固体(有两种物质)加盐酸有能使石灰水变浑浊的气体放出,其中一种固体为碳酸钠,另一种固体为C;
(5)根据C不溶于水分析,将4中固体加足量水,有不溶黑色固体,则生成物中有C,在所得水溶液中加入过量BaCl2溶液,有沉淀生成,说明有Na2CO3生成;过滤,用pH试纸检验滤液,若滤液呈碱性,则残留固体中含有Na2O.
(2)制取二氧化碳时,为了使制气过程具有“随开随用,随关随停”的特点,应该选用能够可以固、液药品分开的装置;
(3)由实验方案图可知,1为二氧化碳发生装置,4为二氧化碳与钠反应装置,加入4装置的二氧化碳应干燥,没有其它,故装置2是除去二氧化碳其它中的HCl,应用饱和的碳酸氢钠溶液,3为干燥装置,吸收水蒸气.反应需要排尽装置内的空气,当5装置中产生白色沉淀,说明空气中的二氧化碳排尽,再加热4处的酒精灯发生反应;
(4)①由题意可知,装置4中的残留固体(只有一种物质)加盐酸有能使石灰水变浑浊的气体放出,说明生成碳酸钠,装置6中有黑色沉淀,说明PdCl2溶液能被CO还原得到黑色的Pd,所以反应物为碳酸钠和CO;
②装置4中残留固体(有两种物质)加盐酸有能使石灰水变浑浊的气体放出,其中一种固体为碳酸钠,另一种固体为C;
(5)根据C不溶于水分析,将4中固体加足量水,有不溶黑色固体,则生成物中有C,在所得水溶液中加入过量BaCl2溶液,有沉淀生成,说明有Na2CO3生成;过滤,用pH试纸检验滤液,若滤液呈碱性,则残留固体中含有Na2O.
解答:
解:(1)由实验方案图可知,1为二氧化碳发生装置,4为二氧化碳与钠反应装置,加入4装置的二氧化碳应干燥,没有其它,故装置2是除去二氧化碳中的HCl,应用饱和的碳酸氢钠溶液,装置3是除去二氧化碳中的水蒸气,应用浓硫酸溶液,
故答案为:饱和碳酸氢钠;浓硫酸;
(2)制取二氧化碳时,为了使制气过程具有“随开随用,随关随停”的特点,应该选用能够可以固、液药品分开的装置,A中只能控制反应的速率,但不能控制反应的随时进行与停止;而C中当打开止水夹时,酸就和有孔塑料板上的石灰石反应生成气体,当关闭止水夹时,生成的气体就无法从导管中排出,从而使装置内的压强增大,把酸液挤到长颈漏斗中,使固液分离,故选:C;
(3)由分析可知,反应需要排尽装置内的空气,当装置5中澄清的石灰水变浑浊,说明空气中的二氧化碳排尽,再加热4处的酒精灯发生反应,
故答案为:白色沉淀(浑浊);排出装置中的空气,防止空气中的O2、CO2、H2O等干扰实验;
(4)①由题意可知,装置4中的残留固体(只有一种物质)加盐酸有能使石灰水变浑浊的气体放出,说明生成碳酸钠,装置6中有黑色沉淀,说明PdCl2溶液能被CO还原得到黑色的Pd,所以反应物为碳酸钠和CO,反应的化学方程式为2Na+2CO2=Na2CO3+CO,故答案为:2Na+2CO2=Na2CO3+CO;
②装置4中残留固体(有两种物质)加盐酸有能使石灰水变浑浊的气体放出,其中一种固体为碳酸钠,另一种固体为C,反应的方程式为4Na+3CO2=2Na2CO3+C,
故答案为:4Na+3CO2=2Na2CO3+C;
(5)将4中固体加足量水,有不溶黑色固体,则生成物中有C,在所得水溶液中加入过量BaCl2溶液,有沉淀生成,说明有Na2CO3生成;过滤,用pH试纸检验滤液,若滤液呈碱性,则残留固体中含有Na2O.
故答案为:(1)溶于足量水中,若有黑色不溶物则证明残留固体中有C
(2)将步骤(1)所得混合物过滤,向滤液中加入足量BaCl2溶液(或CaCl2溶液),若出现白色沉淀,证明残留固体中有Na2CO3
(3)将步骤(2)所得混合物过滤,向滤液(或取上层清液)中滴加几滴酚酞,若溶液变红,则证明残留物中含有Na2O
故答案为:饱和碳酸氢钠;浓硫酸;
(2)制取二氧化碳时,为了使制气过程具有“随开随用,随关随停”的特点,应该选用能够可以固、液药品分开的装置,A中只能控制反应的速率,但不能控制反应的随时进行与停止;而C中当打开止水夹时,酸就和有孔塑料板上的石灰石反应生成气体,当关闭止水夹时,生成的气体就无法从导管中排出,从而使装置内的压强增大,把酸液挤到长颈漏斗中,使固液分离,故选:C;
(3)由分析可知,反应需要排尽装置内的空气,当装置5中澄清的石灰水变浑浊,说明空气中的二氧化碳排尽,再加热4处的酒精灯发生反应,
故答案为:白色沉淀(浑浊);排出装置中的空气,防止空气中的O2、CO2、H2O等干扰实验;
(4)①由题意可知,装置4中的残留固体(只有一种物质)加盐酸有能使石灰水变浑浊的气体放出,说明生成碳酸钠,装置6中有黑色沉淀,说明PdCl2溶液能被CO还原得到黑色的Pd,所以反应物为碳酸钠和CO,反应的化学方程式为2Na+2CO2=Na2CO3+CO,故答案为:2Na+2CO2=Na2CO3+CO;
②装置4中残留固体(有两种物质)加盐酸有能使石灰水变浑浊的气体放出,其中一种固体为碳酸钠,另一种固体为C,反应的方程式为4Na+3CO2=2Na2CO3+C,
故答案为:4Na+3CO2=2Na2CO3+C;
(5)将4中固体加足量水,有不溶黑色固体,则生成物中有C,在所得水溶液中加入过量BaCl2溶液,有沉淀生成,说明有Na2CO3生成;过滤,用pH试纸检验滤液,若滤液呈碱性,则残留固体中含有Na2O.
故答案为:(1)溶于足量水中,若有黑色不溶物则证明残留固体中有C
(2)将步骤(1)所得混合物过滤,向滤液中加入足量BaCl2溶液(或CaCl2溶液),若出现白色沉淀,证明残留固体中有Na2CO3
(3)将步骤(2)所得混合物过滤,向滤液(或取上层清液)中滴加几滴酚酞,若溶液变红,则证明残留物中含有Na2O
点评:本题联系学生感兴趣的实际新知识,有助于学生能力的考查,必须活学活用才能解好这类有新意的试题.

练习册系列答案
 文敬图书课时先锋系列答案
文敬图书课时先锋系列答案
相关题目
下列有关实验操作、现象或实验原理叙述错误的是( )
| A、纸层折法分离Fe3+和Cu2+的实验中,点样后的滤纸需晾干后可使用 |
| B、在中和热测定的实验中,可将反应前氢氧化钠溶液的温度作为起始温度 |
| C、将Kcl和NaNO3的混合液加热并浓缩至有晶体析出时,趁热过滤可分离得NaCl晶体 |
| D、(镀锌铁皮锌镀层厚度的测定)实验中,当锌完全溶解后,铁与酸反应产生氢气的速率会显著减慢,借此可判断锌镀层是否反应完全 |
下列有关实验的操作,原理和现象的叙述不正确的是( )
| A、分液操作时,若要回收上层液体,应先从上口倒出上层液体,再从下口将下层液体放出 |
| B、浓的NaOH溶液不慎溅到皮肤上,可无用大量水冲洗,再涂上硼酸或稀醋酸溶液 |
| C、AlCl3溶液中加入过量NaF固体,再滴加氨水,无沉淀产生说明[AlF6]3-很难电离 |
| D、检验Cl-时,为了排除SO42-的干扰,可先滴加过量的Ba(NO3)2溶液后,取上层溶液,再滴加AgNO3溶液,若有白色沉淀,则表明原溶液中有Cl-存在 |
下列实验误差分析错误的是( )
| A、用湿润的pH试纸测稀碱液的pH,测定值偏小 |
| B、酸碱中和滴定时用待测液润洗锥形瓶,所测结果偏高 |
| C、滴定前滴定管内无气泡,终点读数时有气泡,所测体积偏小 |
| D、测定中和反应的反应热时,将碱缓慢倒入酸中,所测最高温度值偏大 |
某溶液中含有SO42-、SO32-、SiO32-、CO32-、Na+,向该溶液中通入过量的Cl2,
下列判断正确的是( )
①反应前后,溶液中离子浓度基本保持不变的有SO42-、Na+;
②有白色胶状物质生成;
③有气体产生;
④发生了氧化还原反应.
下列判断正确的是( )
①反应前后,溶液中离子浓度基本保持不变的有SO42-、Na+;
②有白色胶状物质生成;
③有气体产生;
④发生了氧化还原反应.
| A、①②③④ | B、②③④ |
| C、①②③ | D、②③ |
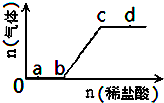 向Na2CO3、NaHCO3混合溶液中逐滴加入稀盐酸,生成气体的量随盐酸加入量的变化关系如图所示.则下列粒子组在对应的溶液中一定能大量共存的是( )
向Na2CO3、NaHCO3混合溶液中逐滴加入稀盐酸,生成气体的量随盐酸加入量的变化关系如图所示.则下列粒子组在对应的溶液中一定能大量共存的是( )| A、a点对应的溶液中:Na+、SO42-、NO3-、Fe(OH)3胶体微粒 |
| B、b点对应的溶液中:Al3+、H+、MnO4-、Cl- |
| C、c点对应的溶液中:Na+、Ca2+、NO3-、Cl- |
| D、d点对应的溶液中:F-、NO3-、Fe2+、Ag+ |
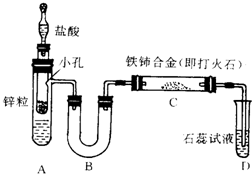 已知亚硝酸铵很不稳定,在溶液中加热能分解生成氮气和水.有人设计以下装置(A中盛有饱和NaNO2与NH4Cl的混合溶液)来进行有关实验.
已知亚硝酸铵很不稳定,在溶液中加热能分解生成氮气和水.有人设计以下装置(A中盛有饱和NaNO2与NH4Cl的混合溶液)来进行有关实验.
 研究硫及其化合物的性质具有重要意义.
研究硫及其化合物的性质具有重要意义.