题目内容
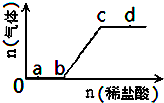 向Na2CO3、NaHCO3混合溶液中逐滴加入稀盐酸,生成气体的量随盐酸加入量的变化关系如图所示.则下列粒子组在对应的溶液中一定能大量共存的是( )
向Na2CO3、NaHCO3混合溶液中逐滴加入稀盐酸,生成气体的量随盐酸加入量的变化关系如图所示.则下列粒子组在对应的溶液中一定能大量共存的是( )| A、a点对应的溶液中:Na+、SO42-、NO3-、Fe(OH)3胶体微粒 |
| B、b点对应的溶液中:Al3+、H+、MnO4-、Cl- |
| C、c点对应的溶液中:Na+、Ca2+、NO3-、Cl- |
| D、d点对应的溶液中:F-、NO3-、Fe2+、Ag+ |
考点:离子反应发生的条件,钠的重要化合物
专题:离子反应专题
分析:向Na2CO3、NaHCO3混合溶液中逐滴加入稀盐酸,首先发生反应:Na2CO3+HCl=NaHCO3+NaCl,然后才发生反应:NaHCO3+HCl=NaCl+CO2↑+H2O,依此结合选项中的离子进行判断.
解答:
解:向Na2CO3、NaHCO3混合溶液中逐滴加入稀盐酸,首先发生反应:Na2CO3+HCl=NaHCO3+NaCl,然后才发生反应:NaHCO3+HCl=NaCl+CO2↑+H2O.
A.a点对应的溶液为Na2CO3、NaHCO3、氯化钠的混合溶液,Fe(OH)3胶体微粒会发生聚沉,故A错误;
B.b点对应的溶液为NaHCO3、氯化钠的混合溶液,铝离子和碳酸氢根离子能发生双水解,故B错误;
C.c点对应的溶液为氯化钠溶液,四种离子可以大量共存,故C正确;
D.d点对应的溶液为氯化钠和稀盐酸的混合溶液,NO3-、Fe2+与氢离子能发生氧化还原反应,故D错误;
故选C.
A.a点对应的溶液为Na2CO3、NaHCO3、氯化钠的混合溶液,Fe(OH)3胶体微粒会发生聚沉,故A错误;
B.b点对应的溶液为NaHCO3、氯化钠的混合溶液,铝离子和碳酸氢根离子能发生双水解,故B错误;
C.c点对应的溶液为氯化钠溶液,四种离子可以大量共存,故C正确;
D.d点对应的溶液为氯化钠和稀盐酸的混合溶液,NO3-、Fe2+与氢离子能发生氧化还原反应,故D错误;
故选C.
点评:本题考查离子共存问题,难度中等.要注意Na2CO3、NaHCO3混合溶液中逐滴加入稀盐酸的反应特点.

练习册系列答案
 津桥教育计算小状元系列答案
津桥教育计算小状元系列答案
相关题目
下列关系式错误的是( )
| A、等浓度的HCN溶液NaCN溶液等体积混合,所得溶液pH>7,则溶液中离子浓度:c(Na+ )>c(CN-)>c(OH- )>c(H+ ) | ||||
| B、0.4mol?L-1某一元酸HA溶液和0.2 mol?L-1NaOH溶液等体积混合的溶液中:2c(OH- )+c(A- )=2c(H+ )+c(HA) | ||||
| C、常温下等浓度的Na2SO3与NaHSO3溶液等体积混合后溶液的pH=7.2,调整比例当溶液呈中性时:c(Na+ )>c(HSO3-)>c(SO32-)>c(H+ )═c(OH- ) | ||||
D、两种弱酸HX和HY混合后,溶液中的c(H+ )为(Ka为电离平衡常数):c(H+ )=
|
硫酸镁常用作制革、炸药、造纸、瓷器、肥料,以及医疗上口服泻药等.已知25℃时,Ksp[Mg(OH)2]=1.0×10-11,Kw=1.0×10-14,Ksp(CaSO4)=9.1×10-6,则下列说法正确的是( )
| A、水是一种极弱的电解质,存在电离平衡H2O?H++OH-.在水中加入少量MgSO4固体时,上述平衡将向正反应方向移动,KW增大 |
| B、在MgSO4溶液中各离子浓度关系:c(Mg2+)+c(OH-)=c(OH-)+c(SO42-) |
| C、向1L0.01 mol.L-1MgSO4溶液中加入1L 0.001 mol.L-1CaCl2溶液即可生成CaSO4沉淀 |
| D、若溶液中某离子的浓度低于1.0×10-5mol.L-1即可认为该离子被除尽,常温下要出去0.1 mol.L-1MgSO4溶液中的Mg2+,至少要调节pH≥11. |
实验室保存下列药品的方法不正确的是( )
| A、氢氟酸保存在密封的玻璃瓶中 |
| B、少量金属钠保存在煤油中 |
| C、硅酸钠保存在带橡皮塞的试剂瓶中 |
| D、氢氧化钠溶液保存在带橡皮塞的试剂瓶中 |
在体积一定的密闭容器中,加入镍粉并充入一定体积的CO,发生反应:Ni(s)+4CO(g)?Ni(CO)(g),已知该反应平衡常数与温度的关系如表:下列说法正确的是( )
| 温度℃ | 25 | 80 |
| 平衡常数 | 5×104 | 2 |
| A、上述反应的正反应为吸热反应 |
| B、25℃时反应Ni(CO)4(g)?Ni(s)+4CO(g)的平衡常数也为5×104 |
| C、在80℃时,测得某时刻,Ni(CO)4、CO浓度均为1mol.L-1,则此时v(正)>v(逆) |
| D、达平衡后,在容器中再加入一定的Ni粉,则平衡会向正反应方向移动 |
不能证明HCN是弱电解质的是( )
| A、1mol.L-1氢氯酸(HCN)的pH约为3 |
| B、常温下,pH=4的氢氯酸稀释100倍后所得溶液pH<6 |
| C、10mL 1 mol.L-1氢氯酸(HCN)恰好与10mL 1 mol.L-1NaOH溶液完全反应 |
| D、常温下,0.1mol.L-1NaCN溶液的pH约为10 |
下列说法中正确的是( )
| A、在氧化还原反应中,一定是一种元素被氧化,另一种元素被还原 |
| B、在氧化还原反应中,不一定所有元素的化合价都发生改变 |
| C、氧化还原反应的实质是元素化合价的升降 |
| D、某元素由化合态转化为游离态,这种元素一定被还原了 |

 +CH2=CH-R
+CH2=CH-R  +HX属于相同反应类型的是( )
+HX属于相同反应类型的是( )


