题目内容
 研究硫及其化合物的性质具有重要意义.
研究硫及其化合物的性质具有重要意义.(1)某学习小组同学将含硫物质分为如图1,3组,则第3组中,实验室里浓X试剂瓶上应贴的标签是
| 第1组 | 第2组 | 第3组 |
| S(单质) | SO2、H2SO3、NaHSO3、Na2SO3 | SO3、X、NaHSO4、Na2SO4 |
(2)钠硫高能电池工作温度为320℃左右,电池反应式为:2Na+xS=Na2SX,则该电池的正极反应式为
(3)取6.4g铜片和15mL 16mol.L-1浓硫酸放在试管中加热,反应的化学方程式为
(4)取一铜片和稀硫酸放入试管,再向其中滴加H2O2,发现溶液变蓝,反应的离子方程式为
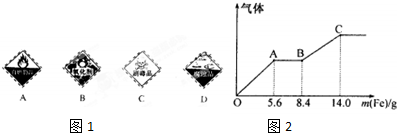
(5)分别向100mL稀硫酸和稀硝酸的混合溶液中加入铜片和铁粉,其中一份最多溶解9.6gCu,而另一份随铁粉加入产生气体的量如图2所示,则OA段产生气体的离子方程式为
考点:有关混合物反应的计算,原电池和电解池的工作原理,浓硫酸的性质,化学试剂的分类
专题:
分析:(1)对比(2)(3)组数据可知X应为H2SO4,具有腐蚀性;
(2)正极发生还原反应,S被还原;
(3)浓硫酸和铜在加热条件下发生氧化还原反应生成硫酸铜和二氧化硫,稀硫酸与铜不反应;
(4)取一铜片和稀硫酸放入试管,再向其中滴加H2O2,发现溶液变蓝,说明铜被氧化生成硫酸铜;
(5)金属铜和稀硝酸反应的方程式为:3Cu+8HNO3=3Cu(NO3)2+2NO+4H2O,根据铁和硫酸的反应中铁的质量来确定所需硫酸的量,进而确定硫酸的浓度.
(2)正极发生还原反应,S被还原;
(3)浓硫酸和铜在加热条件下发生氧化还原反应生成硫酸铜和二氧化硫,稀硫酸与铜不反应;
(4)取一铜片和稀硫酸放入试管,再向其中滴加H2O2,发现溶液变蓝,说明铜被氧化生成硫酸铜;
(5)金属铜和稀硝酸反应的方程式为:3Cu+8HNO3=3Cu(NO3)2+2NO+4H2O,根据铁和硫酸的反应中铁的质量来确定所需硫酸的量,进而确定硫酸的浓度.
解答:
解:(1)对比(2)(3)组数据可知X应为H2SO4,具有腐蚀性,故答案为:D;
(2)正极发生还原反应,S被还原生成Sn2-,电极方程式为xS+2e-═Sn2-,故答案为:xS+2e-═Sn2-;
(3)浓硫酸和铜在加热条件下发生氧化还原反应生成硫酸铜和二氧化硫,方程式为Cu+2H2SO4(浓)
CuSO4+SO2↓+2H2O,随反应进行,硫酸浓度变稀,稀硫酸和铜不反应,实验结束后,试管中还有铜片剩余,
故答案为:Cu+2H2SO4(浓)
CuSO4+SO2↓+2H2O;随反应进行,硫酸浓度变稀,稀硫酸和铜不反应;
(4)取一铜片和稀硫酸放入试管,再向其中滴加H2O2,发现溶液变蓝,说明铜被氧化生成硫酸铜,方程式为Cu+2H++H2O2═Cu2++2H2O,
故答案为:Cu+2H++H2O2═Cu2++2H2O;
(5)OA段生成气体为NO,反应的离子方程式为Fe+NO3-+4H+═Fe3++NO↑+2H2O,反应消耗14g铁,也就是0.25mol,所有的铁都在硫酸亚铁中,所以每份含硫酸0.25mol,浓度是2.5mol/L,
故答案为:Fe+NO3-+4H+═Fe3++NO↑+2H2O;2.5mol.L-1.
(2)正极发生还原反应,S被还原生成Sn2-,电极方程式为xS+2e-═Sn2-,故答案为:xS+2e-═Sn2-;
(3)浓硫酸和铜在加热条件下发生氧化还原反应生成硫酸铜和二氧化硫,方程式为Cu+2H2SO4(浓)
| ||
故答案为:Cu+2H2SO4(浓)
| ||
(4)取一铜片和稀硫酸放入试管,再向其中滴加H2O2,发现溶液变蓝,说明铜被氧化生成硫酸铜,方程式为Cu+2H++H2O2═Cu2++2H2O,
故答案为:Cu+2H++H2O2═Cu2++2H2O;
(5)OA段生成气体为NO,反应的离子方程式为Fe+NO3-+4H+═Fe3++NO↑+2H2O,反应消耗14g铁,也就是0.25mol,所有的铁都在硫酸亚铁中,所以每份含硫酸0.25mol,浓度是2.5mol/L,
故答案为:Fe+NO3-+4H+═Fe3++NO↑+2H2O;2.5mol.L-1.
点评:本题考查较为综合,涉及原电池、浓硫酸、铜以及硝酸的性质,侧重学生的分析、计算能力的考查,为高频考点,注意把握物质的性质,为解答该题的关键,难度不大.

练习册系列答案
 举一反三单元同步过关卷系列答案
举一反三单元同步过关卷系列答案
相关题目
下列溶液一定是显酸性的是( )
| A、pH<7的溶液 |
| B、c(H+)>c(OH-)的溶液 |
| C、能与金属Al反应放出H2的溶液 |
| D、滴加酚酞后显无色的溶液 |
下列图象表达正确的是( )
A、 表示向1L浓度均为0.1mol.L-1的Ba(OH)2、NaAlO2混合液中逐滴加入0.1mol.L-1稀H2SO4溶液 |
B、 表示常温下,两份足量、等浓度的盐酸与等量锌粉反应时,其中一份滴加了少量硫酸铜溶液 |
C、 表示向CaCl2和盐酸的混合溶液中滴加Na2CO3溶液 |
D、 表示向醋酸溶液中滴入氨水 |
 25℃时,20mL0.1mol?L-1氨水溶液中逐滴加入0.2mol?L-1HCl溶液(如图),下列说法正确的是( )
25℃时,20mL0.1mol?L-1氨水溶液中逐滴加入0.2mol?L-1HCl溶液(如图),下列说法正确的是( )| A、在A、C间任一点,溶液中一定都有:c(NH4+)>c(Cl-)>c(OH-)>c(H+) |
| B、在C点,c<10,且有c(NH4+)=c(Cl-)=c(OH-)=c(H+) |
| C、若25℃时 0.1mol/L 氨水电离度为1.33%,则b<a<12 |
| D、在D点:c(NH4+)+c(NH3?H2O)=2c(Cl-) |
在体积一定的密闭容器中,加入镍粉并充入一定体积的CO,发生反应:Ni(s)+4CO(g)?Ni(CO)(g),已知该反应平衡常数与温度的关系如表:下列说法正确的是( )
| 温度℃ | 25 | 80 |
| 平衡常数 | 5×104 | 2 |
| A、上述反应的正反应为吸热反应 |
| B、25℃时反应Ni(CO)4(g)?Ni(s)+4CO(g)的平衡常数也为5×104 |
| C、在80℃时,测得某时刻,Ni(CO)4、CO浓度均为1mol.L-1,则此时v(正)>v(逆) |
| D、达平衡后,在容器中再加入一定的Ni粉,则平衡会向正反应方向移动 |
 苯和溴取代反应的实验装置如图所示,其中A为由具支试管改制成的反应容器,在其下端开了一小孔,塞好石棉绒,再加入少量铁屑粉.填写下列空白:
苯和溴取代反应的实验装置如图所示,其中A为由具支试管改制成的反应容器,在其下端开了一小孔,塞好石棉绒,再加入少量铁屑粉.填写下列空白: 现有氨水、醋酸、盐酸、氯化铵四种溶液,请回答下列问题:
现有氨水、醋酸、盐酸、氯化铵四种溶液,请回答下列问题:
