题目内容
已知常见的弱酸在25℃时的电离平衡常数为:
(1)等浓度的CH3COOH、H2SO3、HClO三种溶液,pH由大到小的顺序为: .
(2)饱和氯水与石灰石的反应是制取较浓的HClO溶液的方法之一,在饱和氯水中加入以下物质中的 (填序号)也可以获得较浓的HClO溶液.
a.Na2CO3 b.NaHCO3 c.Na2SO3 d.NaOH
(3)草酸(H2C2O4)溶液与少量Na2CO3溶液混合反应的离子方程式为: .
(4)若某醋酸溶液中醋酸的起始浓度为0.010mol/L,平衡时C(H+)= mol/L.
(提示:醋酸的电离程度很小,平衡时c(CH3COOH)可近似认为等于起始浓度)
(5)将浓度为0.1mol/L的H2SO4溶液与0.1mol/L的NaOH溶液按一定的体积比混合后,所得混合溶液的pH为2,则H2SO4与NaOH的体积比为 ,此时溶液中所有离子的浓度大小顺序为: .
| 酸 | Ka1 | Ka2 |
| H2C2O4 | 5.9×10-2 | 6.4×10-5 |
| H2CO3 | 4.2×10-7 | 5.6×10-11 |
| H2SO3 | 1.3×10-2 | 5.6×10-8 |
| HClO | 4.7×10-10 | |
| CH3COOH | 1.6×10-5 |
(2)饱和氯水与石灰石的反应是制取较浓的HClO溶液的方法之一,在饱和氯水中加入以下物质中的
a.Na2CO3 b.NaHCO3 c.Na2SO3 d.NaOH
(3)草酸(H2C2O4)溶液与少量Na2CO3溶液混合反应的离子方程式为:
(4)若某醋酸溶液中醋酸的起始浓度为0.010mol/L,平衡时C(H+)=
(提示:醋酸的电离程度很小,平衡时c(CH3COOH)可近似认为等于起始浓度)
(5)将浓度为0.1mol/L的H2SO4溶液与0.1mol/L的NaOH溶液按一定的体积比混合后,所得混合溶液的pH为2,则H2SO4与NaOH的体积比为
考点:弱电解质在水溶液中的电离平衡,离子浓度大小的比较
专题:
分析:(1)同一温度下,酸的电离常数越大其酸性越强,根据酸的电离常数确定酸性强弱;
(2)根据影响平衡的因素分析;
(3)根据酸性强弱判断反应及反应产物;
(4)根据醋酸的电离常数计算;
(5)浓度为0.1mol/L的H2SO4溶液与0.1mol/L的NaOH溶液按一定的体积比混合后,所得混合溶液的pH=2,则硫酸过量,利用剩余氢离子的浓度计算溶液的体积比;根据各离子的浓度及酸碱性判断离子浓度关系.
(2)根据影响平衡的因素分析;
(3)根据酸性强弱判断反应及反应产物;
(4)根据醋酸的电离常数计算;
(5)浓度为0.1mol/L的H2SO4溶液与0.1mol/L的NaOH溶液按一定的体积比混合后,所得混合溶液的pH=2,则硫酸过量,利用剩余氢离子的浓度计算溶液的体积比;根据各离子的浓度及酸碱性判断离子浓度关系.
解答:
解:(1)同一温度下,酸的电离常数越大其酸性越强,根据酸的电离常数知,酸性最强的是H2SO3,最弱的是HClO,则它们酸性强弱顺序是HClO<CH3COOH<H2SO3,酸性越弱,则PH越大,所以pH由大到小的顺序为:HClO>CH3COOH>H2SO3;
故答案为:HClO>CH3COOH>H2SO3;
(2)氯气与水反应生成盐酸和次氯酸:Cl2+H2O?H++Cl-+HClO,加入的物质能与盐酸反应,而不用HClO反应,则平衡正移,HClO的浓度增大,Na2CO3 、Na2SO3、NaOH均能与次氯酸反应,会使次氯酸浓度减小,NaHCO3 与盐酸反应,而不用HClO反应,HClO的浓度增大;
故答案为:b;
(3)根据酸的电离常数可知,酸性:H2C2O4>H2CO3,则草酸(H2C2O4)溶液与少量Na2CO3溶液混合反应的离子方程式为2H2C2O4+CO32-=2HC2O4-+H2O+CO2↑;
故答案为:2H2C2O4+CO32-=2HC2O4-+H2O+CO2↑;
(4)已知醋酸的电离常数为1.6×10-5,Ka=
=
=1.6×10-5,解得:c(H+)=4.00×10-4mol/L;
故答案为:4.00×10-4;
(5)浓度为0.1mol/L的H2SO4溶液与0.1mol/L的NaOH溶液按一定的体积比混合后,所得混合溶液的pH=2,则硫酸过量,设硫酸的体积为V1,氢氧化钠为V2,
c(H+)=
=0.01,则
=
,
混合后c(Na+)=
=0.063mol/L,c(SO42-)=
=0.037mol/L,
所以此时溶液中所有离子的浓度大小顺序为:c(Na+)>c(SO42-)>c(H+)>c(OH-);
故答案为:
;c(Na+)>c(SO42-)>c(H+)>c(OH-).
故答案为:HClO>CH3COOH>H2SO3;
(2)氯气与水反应生成盐酸和次氯酸:Cl2+H2O?H++Cl-+HClO,加入的物质能与盐酸反应,而不用HClO反应,则平衡正移,HClO的浓度增大,Na2CO3 、Na2SO3、NaOH均能与次氯酸反应,会使次氯酸浓度减小,NaHCO3 与盐酸反应,而不用HClO反应,HClO的浓度增大;
故答案为:b;
(3)根据酸的电离常数可知,酸性:H2C2O4>H2CO3,则草酸(H2C2O4)溶液与少量Na2CO3溶液混合反应的离子方程式为2H2C2O4+CO32-=2HC2O4-+H2O+CO2↑;
故答案为:2H2C2O4+CO32-=2HC2O4-+H2O+CO2↑;
(4)已知醋酸的电离常数为1.6×10-5,Ka=
| c(CH3COO-)?c(H+) |
| c(CH3COOH) |
| c2(H+) |
| 0.01 |
故答案为:4.00×10-4;
(5)浓度为0.1mol/L的H2SO4溶液与0.1mol/L的NaOH溶液按一定的体积比混合后,所得混合溶液的pH=2,则硫酸过量,设硫酸的体积为V1,氢氧化钠为V2,
c(H+)=
| 0.1×2×V1-0.1×V2 |
| V1+V2 |
| V1 |
| V2 |
| 11 |
| 19 |
混合后c(Na+)=
| 0.1×19 |
| 11+19 |
| 0.1×11 |
| 11+19 |
所以此时溶液中所有离子的浓度大小顺序为:c(Na+)>c(SO42-)>c(H+)>c(OH-);
故答案为:
| 11 |
| 19 |
点评:本题考查了酸的电离常数与酸性强弱的关系、pH的有关计算等,题目计算量较大,熟悉Ka及混合溶液中氢离子的浓度的计算方法是解答的关键,题目难度中等.

练习册系列答案
相关题目
下列各项表达中不正确的是( )
| A、Be2+中的电子数和质子数之比一定为1:2 |
| B、D216O中,质量数之和是质子数之和的两倍 |
| C、在氮原子中,质子数为7而中子数不一定为7 |
D、Cl-的结构示意图为: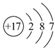 |
NA表示阿伏加德罗常数,下列叙述正确的是( )
| A、6.4g铜粉与足量硫粉充分反应,失去的电子数为0.2NA |
| B、Na2O2与足量H2O反应生成0.2mol O2,转移电子的数目为0.4NA |
| C、标准状况下,22.4L氯气与足量氢氧化钠溶液反应转移的电子数为2NA |
| D、0.5mol?L-1 CuCl2溶液中含有Cu2+数小于0.5NA |
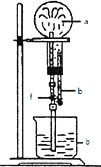 在图装置中,烧瓶中充满干燥气体a,将滴管中的液体b挤入烧瓶内,轻轻振荡烧瓶,然后打开弹夹f,烧杯中的液体b呈喷泉状喷出,最终几乎充满烧瓶.则a和b分别是( )
在图装置中,烧瓶中充满干燥气体a,将滴管中的液体b挤入烧瓶内,轻轻振荡烧瓶,然后打开弹夹f,烧杯中的液体b呈喷泉状喷出,最终几乎充满烧瓶.则a和b分别是( )| A、NO和H2O |
| B、Cl2和饱和食盐水 |
| C、NH3和水 |
| D、NO2和H2O |
 A、B、C、D、E、F六种元素位于周期表前四周期且原子序数依次增大.①A元素的一种核素中子数是质子数的2倍;②基态B原子核外有两个未成对电子;③大气中C的游离态含量最高;④D原子基态核外电子运动状态共8种;⑤E、F原子序数相差3,基态E原子中有4个未成对屯子且全在同一能级内.
A、B、C、D、E、F六种元素位于周期表前四周期且原子序数依次增大.①A元素的一种核素中子数是质子数的2倍;②基态B原子核外有两个未成对电子;③大气中C的游离态含量最高;④D原子基态核外电子运动状态共8种;⑤E、F原子序数相差3,基态E原子中有4个未成对屯子且全在同一能级内.