题目内容
已知反应:
①SO3+H2O=H2SO4
②Cl2+H2O=HCl+HClO
③2F2+2H2O=4HF+O2↑
④2Na+2H2O=2NaOH+H2↑
⑤2Na2O2+2H2O=4NaOH+O2↑
⑥SiO2+2NaOH=Na2SiO3+H2O
(1)上述反应中不属于氧化还原反应的有 (填序号,下同).H2O被氧化的是 H2O被还原的是 .属于氧化还原反应,但其中的H2O既不被氧化,又不被还原的是 .
(2)写出方程式②的离子方程式 .
(3)标出方程式④的电子转移的方向和数目 .
①SO3+H2O=H2SO4
②Cl2+H2O=HCl+HClO
③2F2+2H2O=4HF+O2↑
④2Na+2H2O=2NaOH+H2↑
⑤2Na2O2+2H2O=4NaOH+O2↑
⑥SiO2+2NaOH=Na2SiO3+H2O
(1)上述反应中不属于氧化还原反应的有
(2)写出方程式②的离子方程式
(3)标出方程式④的电子转移的方向和数目
考点:氧化还原反应
专题:氧化还原反应专题
分析:(1)含元素化合价变化的反应为氧化还原反应,水被氧化,则水中O元素的化合价升高,水被还原,则水中H元素的化合价降低;若水中H、O元素的化合价不变,则H2O既不被氧化,又不被还原;
(2)只有HCl为强电解质,完全电离,其它物质均需保留化学式;
(3)Na元素的化合价由0升高为+1价,H元素的化合价由+1价降低为0,以此来解答.
(2)只有HCl为强电解质,完全电离,其它物质均需保留化学式;
(3)Na元素的化合价由0升高为+1价,H元素的化合价由+1价降低为0,以此来解答.
解答:
解:(1)只有①⑥反应中没有元素的化合价变化,不属于氧化还原反应;只有③水中O元素的化合价升高,水被还原;只有④水中H元素的化合价降低,水被氧化;只有②⑤中属于氧化还原反应,但水中H、O元素的化合价不变,则H2O既不被氧化,又不被还原,
故答案为:①⑥;③;④;②⑤;
(2)Cl2+H2O=HCl+HClO的离子反应为Cl2+H2O=H++Cl-+HClO,故答案为:Cl2+H2O=H++Cl-+HClO;
(3)Na元素的化合价由0升高为+1价,H元素的化合价由+1价降低为0,电子转移的方向和数目为 ,
,
故答案为: .
.
故答案为:①⑥;③;④;②⑤;
(2)Cl2+H2O=HCl+HClO的离子反应为Cl2+H2O=H++Cl-+HClO,故答案为:Cl2+H2O=H++Cl-+HClO;
(3)Na元素的化合价由0升高为+1价,H元素的化合价由+1价降低为0,电子转移的方向和数目为
 ,
,故答案为:
 .
.
点评:本题考查氧化还原反应,为高频考点,把握反应中元素的化合价变化为解答的关键,侧重氧化还原反应基本概念及转移电子的考查,题目难度不大.

练习册系列答案
相关题目
28g铁粉与2.2g硫粉均匀混合,在密闭容器中加热,冷却后加入足量盐酸,在标准状况下收集到气体的体积是( )
| A、11.2L | B、5.6L |
| C、4.48L | D、2.24L |
下列说法中错误的是( )
| A、化学反应中的能量变化通常表现为热量的变化 |
| B、化学键的断裂和形成是化学反应中能量变化的主要原因 |
| C、反应物总能量和生成物总能量的相对大小决定了反应是放出能量还是吸收能量 |
| D、需要加热才能发生的化学反应一定是吸热反应 |
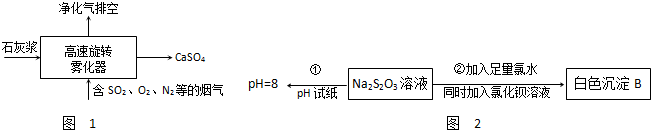
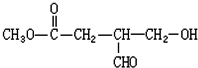
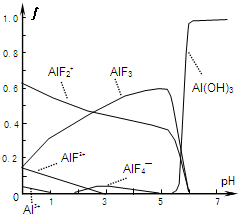 Ⅰ.氟和氟盐是化工原料.由于氟气性质活泼,很晚才制取出来.(1)不能通过电解纯净的液态HF获得F2,其原因是
Ⅰ.氟和氟盐是化工原料.由于氟气性质活泼,很晚才制取出来.(1)不能通过电解纯净的液态HF获得F2,其原因是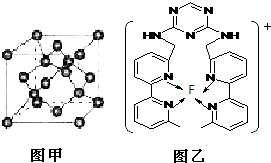 现有A、B、C、D、E、F原子序数依次增大的六种元素,它们位于元素周期表的前四周期.A元素能级个数与核外电子数相等,B元素含有3个能级,且每个能级所含的电子数相同;D的原子核外有8个运动状态不同的电子;E元素与F元素处于同一周期相邻的族,它们的原子序数相差3,且E元素的基态原子有4个未成对电子.请回答下列问题:
现有A、B、C、D、E、F原子序数依次增大的六种元素,它们位于元素周期表的前四周期.A元素能级个数与核外电子数相等,B元素含有3个能级,且每个能级所含的电子数相同;D的原子核外有8个运动状态不同的电子;E元素与F元素处于同一周期相邻的族,它们的原子序数相差3,且E元素的基态原子有4个未成对电子.请回答下列问题: