题目内容
3.A、B、C、D均是短周期元素,A和B同周期,B和C同族,A元素族序数是周期数的三倍,B原子最外层电子数是内层电子数的二倍,B与A能生成化合物BA2,C与A生成化合物CA2,A的阴离子与D的阳离子电子层结构相同,都与氖原子的电子层结构相同,D的单质与A的单质在不同条件下反应,可生成D2A或D2A2.请回答(1)写出元素符号B:CD:Na
(2)BA2的电子式
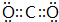 .D2A2中所含化学键类型为非极性共价键和离子键.
.D2A2中所含化学键类型为非极性共价键和离子键.(3)用电子式表示D2A形成过程
 .
.(4)C在元素周期表中的位置是第三周期ⅣA族.A与D分别形成的简单离子半径从大到小关系为O2->Na+.
分析 A、B、C、D均是短周期元素,A元素族序数是周期数的三倍,A只能处于第二周期,族序数为Ⅵ,故A为O元素;A和B同周期,B原子最外层电子数是内层电子数的二倍,最外层电子数为4,则B为C元素;B和C同族,则C为Si;A的阴离子与D的阳离子电子层结构相同,都与氖原子的电子层结构相同,D的单质与A的单质在不同条件下反应,可生成D2A或D2A2,则D为Na,据此解答.
解答 解:A、B、C、D均是短周期元素,A元素族序数是周期数的三倍,A只能处于第二周期,族序数为Ⅵ,故A为O元素;A和B同周期,B原子最外层电子数是内层电子数的二倍,最外层电子数为4,则B为C元素;B和C同族,则C为Si;A的阴离子与D的阳离子电子层结构相同,都与氖原子的电子层结构相同,D的单质与A的单质在不同条件下反应,可生成D2A或D2A2,则D为Na,
(1)由上述分析可知,B为C元素,D为Na元素,故答案为:C;Na;
(2)CO2分子中碳原子与氧原子之间形成2对共用电子对,电子式为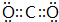 ,过氧化钠中化学键类型为非极性共价键和离子键,故答案为:
,过氧化钠中化学键类型为非极性共价键和离子键,故答案为: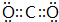 ;非极性共价键和离子键;
;非极性共价键和离子键;
(3)D为Na元素,A为O元素,D2A2的化学式为Na2O2,Na2O为离子化合物,用电子式表示Na2O的形成过程为: ;
;
故答案为: ;
;
(4)C为Si,在元素周期表中的位置是第三周期ⅣA族,电子层结构相同的核电荷数越大半径越小,所以O2->Na+,故答案为:第三周期ⅣA族;O2->Na+.
点评 本题考查结构性质位置关系应用,推断元素是解题关键,侧重对基础知识的巩固,注意对基础知识的掌握.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
4.下列有关叙述正确的是( )
| A. | CCl4可用于鉴别溴水和碘水 | |
| B. | 甲苯(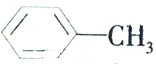 )中所有原子都在同一平面内 )中所有原子都在同一平面内 | |
| C. | 1mol甲苯含有6NA个C-H键 | |
| D. | 苯与甲苯互为同系物,均能使酸性KMnO4溶液褪色 |
14.下列说法不正确的是( )
| A. | 利用盖斯定律可计算某些难以直接测量的反应焓变 | |
| B. | 如果一个热化学方程式可通过其他几个热化学方程式相加减而得到,则该反应的焓变可由相对应的热化学方程式的焓变相加减而得到 | |
| C. | 当同一个化学反应以不同的途径完成时,反应的焓变也是不同的 | |
| D. | 对于放热反应,放出的热量越多,焓变越小 |
11.将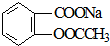 转变为
转变为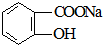 的方法为( )
的方法为( )
 转变为
转变为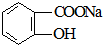 的方法为( )
的方法为( )| A. | 与足量NaOH溶液共热后,再通入CO2 | |
| B. | 与足量NaOH溶液共热后,再加入稀硫酸 | |
| C. | 与稀硫酸共热后,加入足量NaOH溶液 | |
| D. | 与足量稀硫酸共热后,加入足量Na2CO3 |
18.相同质量的Mg和Al分别投入足量的盐酸中,产生的气体在标准状况下的体积比为( )
| A. | 3:4 | B. | 4:3 | C. | 3:2 | D. | 2:3 |
8.下列化合物中同分异构体数目最少的是( )
| A. | 戊醇 | B. | 戊烷 | ||
| C. | 戊烯 | D. | 戊醛(C5H10O,仅含一个-CHO) |
15.下列对离子颜色说法不正确的是( )
| A. | Cu2+ 蓝色 | B. | MnO4-紫红色 | C. | Na+黄色 | D. | Fe3+棕黄色 |
12.类比推理是化学学习中的一种重要方法.下列类推结论正确的是( )
| 选项 | 类比对象 | 结论 |
| A | 2F2+2H2O═4HF+O2 | 2I2+H2O═4HI+O2↑ |
| B | C+2CuO$\frac{\underline{\;高温\;}}{\;}$2Cu+CO2↑ | 3C+2Fe2O3$\frac{\underline{\;高温\;}}{\;}$4Fe+3CO2↑ |
| C | Na2O+H2O═2NaOH | FeO+H2O═Fe(OH)2 |
| D | Ca(ClO)2+CO2+H2O═CaCO3↓+2HClO | Ca(ClO)2+SO2+H2O═CaSO3↓+2HClO |
| A. | A | B. | B | C. | C | D. | D |