题目内容
13.相同物质的量的C3H6、C4H8O2完全燃烧,消耗氧气物质的量关系为<(填编号,用“>”或“=”或“<”表示).分析 设有机物通式为CxHyOz,则1mol下列物质耗氧量依据(x+$\frac{y}{4}$-$\frac{z}{2}$)计算分析判断排序.
解答 解:1mol下列物质:①C3H6 ②C4H8O2,完全燃烧需要O2物质的量为
①1molC3H6 耗氧量=1mol(x+$\frac{y}{4}$-$\frac{z}{2}$)=1mol×(3+$\frac{6}{4}$)=4.5mol;
②C4H8O2耗氧量=1mol×(x+$\frac{y}{4}$-$\frac{z}{2}$)=1mol×(4+$\frac{8}{4}$-$\frac{2}{2}$)=5mol;
所以耗氧量顺序为C3H6<C4H8O2,
故答案为:<.
点评 本题考查了有机物耗氧量的计算应用,掌握耗氧量的计算方法和是解题关键,题目较简单.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
4.关于一个自发进行的放热反应,且属于氧化还原反应.下列叙述正确的是( )
| A. | 反应不需要加热即可进行反应 | |
| B. | 反应物的总能量低于生成物的总能量 | |
| C. | 反应物的总键能高于生成物的总键能 | |
| D. | 理论上可以使该反应的化学能直接转化为电能 |
8.反应N2+O2═2NO,在密闭容器中进行,下列条件能加快该反应的速率的是( )
| A. | 增大容器体积 | B. | 体积不变,充入N2使压强增大 | ||
| C. | 体积不变,充入He使压强增大 | D. | 压强不变,充入N2使体积增大 |
18.有关化学用语正确的是( )
| A. | 硫酸钠的电离方程式:Na2SO4=Na2++SO42- | |
| B. | Mg2+的结构示意图: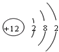 | |
| C. | 氮气的结构式::N≡N: | |
| D. | 氯化镁的电子式: |
2.在2A(s)+B(g)?3C(g)+4D(g)反应中,表示该反应速率最快的是( )
| A. | υ(A)=1.5 mol•L-1•s-1 | B. | υ(B)=0.5 mol•L-1•s-1 | ||
| C. | υ(C)=0.8 mol•L-1•s-1 | D. | υ(D)=1 mol•L-1•s-1 |
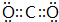 .D2A2中所含化学键类型为非极性共价键和离子键.
.D2A2中所含化学键类型为非极性共价键和离子键. .
.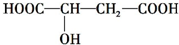
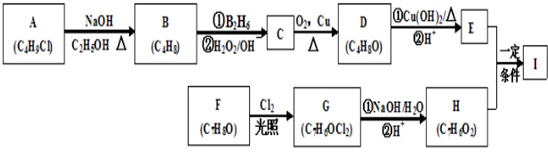
 .
. .
. .
. 2014年诺贝尔物理学奖得主的贡献是发明了一种高效而环保的光源--蓝色发光二极管(LED).某同学对此非常感兴趣,请你帮助某同学完成资料收集的工作.
2014年诺贝尔物理学奖得主的贡献是发明了一种高效而环保的光源--蓝色发光二极管(LED).某同学对此非常感兴趣,请你帮助某同学完成资料收集的工作.