题目内容
3.氯化钾样品中含有少量碳酸钾、硫酸钾和不溶于水的杂质.为了提纯氯化钾,先将样品溶于适量水中,充分搅拌后过滤,再将滤液按图所示步骤进行操作.回答下列问题:(1)步骤①中发生反应的离子方程式为SO42-+Ba2+=BaSO4↓,CO32-+Ba2+=BaCO3↓.
(2)步骤②中加入K2CO3溶液的目的是除过量BaCl2
(3)试剂x的名称是盐酸,步骤③中发生反应的离子方程式为CO32-+2H+=CO2↑+H2O.
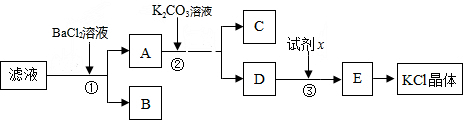
分析 氯化钾样品中含有少量碳酸钾、硫酸钾和不溶于水的杂质,除去碳酸根离子和硫酸根离子,由流程可知,需要加入过量氯化钡溶液,然后过滤后获得含氯化钡、氯化钾溶液A,B为硫酸钡、碳酸钡沉淀,然后加入过量的碳酸钾溶液除去溶液中的氯化钡,C为碳酸钡,过滤,得到含氯化钾和碳酸钾混合液的D,再加入试剂x为过量盐酸,除去过量的碳酸钾,最后通过加热浓缩、蒸发结晶得到氯化钾,以此来解答.
解答 解:(1)要除掉杂质离子硫酸根和碳酸根,加入过量的氯化钡溶液,碳酸根和硫酸根生成不溶于水的钡盐,同时生成氯化钾,离子方程式为:SO42-+Ba2+=BaSO4↓,CO32-+Ba2+=BaCO3↓.
故答案为:SO42-+Ba2+=BaSO4↓,CO32-+Ba2+=BaCO3↓;
(2)要除掉多余的钡离子,要加入碳酸钾,碳酸钾和氯化钡反应生成碳酸钡沉淀同时生成氯化钾,离子方程式为CO32-+Ba2+=BaCO3↓.
故答案为:除过量BaCl2;
(3)要除掉多余的碳酸根,要滴加适量的盐酸,碳酸根离子和盐酸反应生成二氧化碳和水,离子方程式为CO32-+2H+=CO2↑+H2O.
故答案为:盐酸;CO32-+2H+=CO2↑+H2O.
点评 本题考查混合物分离提纯的综合应用,为高频考点,把握物质的性质、流程中的反应及混合物分离方法为解答的关键,侧重分析、实验能力的考查,题目难度不大.

练习册系列答案
相关题目
14.常温下,下列叙述不正确的是( )
| A. | 两种醋酸溶液的物质的量浓度分别为c1和c2,pH分别为a和a+1,则c1>10c2 | |
| B. | NaB溶液的pH=8,c(HB)=9.9×10-7mol•L-1 | |
| C. | 向H2SO3溶液中加入NaOH溶液至溶液恰好呈中性,此时c(Na+)>2c(SO32-) | |
| D. | 25℃时,向0.1mol•L-1的NH4HSO4溶液中滴加NaOH溶液至中性:c(Na+)>c(NH4+)>c(SO42-)>c(OH-)=c(H+) |
8.一定温度下1mol NH4HS固体在定容真空容器中可部分分解为硫化氢和氨气,当反应达平衡时ρ氢气×ρ硫化氢=a(Pa2),则容器中的总压为( )
| A. | 2aPa | B. | 2$\sqrt{a}$Pa | C. | $\frac{2}{3}$aPa | D. | 无法确定 |
15.分子式为C4H10O的有机物含有-CH2OH基团的同分异构体有( )
| A. | 2种 | B. | 3种 | C. | 4种 | D. | 5种 |
12.下列各组离子中,因为发生氧化还原反应而不能共存的是( )
| A. | K+、MnO4-、Na+、I- | B. | Mg2+、Na+、NO3-、CO32- | ||
| C. | AlO2-、NO3-、H+、SO42- | D. | CH3COO-、Na+、SO42-、H+、 |
16.下列关于烷烃与烯烃的说法中正确的是( )
| A. | 烯烃的含碳量一定高于烷烃 | |
| B. | 烷烃分子中只含有碳碳单键,烯烃分子中只含有碳碳双键 | |
| C. | 烷烃不能发生加成反应,烯烃不能发生取代反应 | |
| D. | 相同条件下,烷烃的沸点一点高于烯烃 |
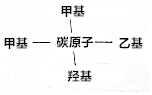 某一元醇的分子式为C5H12O,它的其中一种结构用文字表述为:
某一元醇的分子式为C5H12O,它的其中一种结构用文字表述为: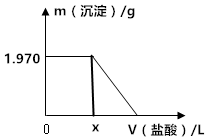 某固体混合物中含有Na2CO3、NaOH、BaCl2.现将3.940g该固体混合物溶于足量水中,结果得到1.970g沉淀;向反应后的试管中逐滴滴加0.5000mol/L的盐酸,加入盐酸的体积和沉淀质量的变化如图所示.
某固体混合物中含有Na2CO3、NaOH、BaCl2.现将3.940g该固体混合物溶于足量水中,结果得到1.970g沉淀;向反应后的试管中逐滴滴加0.5000mol/L的盐酸,加入盐酸的体积和沉淀质量的变化如图所示.