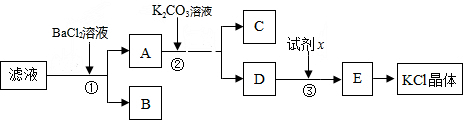
题目内容
14.常温下,下列叙述不正确的是( )| A. | 两种醋酸溶液的物质的量浓度分别为c1和c2,pH分别为a和a+1,则c1>10c2 | |
| B. | NaB溶液的pH=8,c(HB)=9.9×10-7mol•L-1 | |
| C. | 向H2SO3溶液中加入NaOH溶液至溶液恰好呈中性,此时c(Na+)>2c(SO32-) | |
| D. | 25℃时,向0.1mol•L-1的NH4HSO4溶液中滴加NaOH溶液至中性:c(Na+)>c(NH4+)>c(SO42-)>c(OH-)=c(H+) |
分析 A、醋酸为弱酸,浓度越大,电离程度越小;
B、pH=8,则c(H+)=1×10-8 mol/L,c(OH-)=1×10-6 mol/L,然后根据电荷守恒和物料守恒进行计算;
C、根据电荷守恒分析;
D、向0.1mol•L-1的NH4HSO4溶液中滴加NaOH至溶液呈中性,则溶液含有(NH4)2SO4、Na2SO4、NH3•H2O三种成分.
解答 解:A、如电离程度相同,pH分别为a和a+1,则c1=10c2,醋酸为弱酸,浓度越大,电离程度越小,则c1>10c2,故A正确;
B、pH=8的NaB溶液中,c(H+)=1×10-8 mol/L、c(OH-)=1×10-6 mol/L,据物料守恒可得:c(Na+)=c(B-)+c(HB),根据电荷守恒可得:c(Na+)-c(B-)=c(OH-)-c(H+)=9.9×10-7 mol/L=c(HB),故B正确;
C、若向H2SO3溶液中加入NaOH溶液至溶液恰好呈中性,溶液中电荷守恒为:c(Na+)+c(H+)=2c(SO32-)+c(HSO3-)+c(OH-),溶液显中性,则c(H+)=c(OH-),则c(Na+)=2c(SO32-)+c(HSO3-),所以c(Na+)>2c(SO32-),故C正确;
D、溶液呈中性,即溶液含有(NH4)2SO4、Na2SO4、NH3•H2O三种成分,b点时c(Na+)=c(SO42-),b点时c(Na+)>c(SO42-),根据N元素与S元素的关系,可以得出c(SO42-)>c(NH4+),故c(Na+)>c(SO42-)>c(NH4+)>c(OH-)=c(H+),故D错误;
故选D.
点评 本题考查了电解质溶液中离子浓度大小、电荷守恒、物料守恒的分析、盐类水解等等,题目难度中等.

练习册系列答案
相关题目
4.在酸性溶液中,Fe2O42-易转化为Fe2+,其反应过程为Fe2O42-+H+-Fe2++H2O.现有KMnO4、Na2CO3、Cu2O、HNO3四种物质,其中一种物质能使上述反应发生,下列说法正确的是( )
| A. | 能使上述反应发生的物质是KMnO4 | |
| B. | 该氧化还原反应的离子方程式中水的计量数为5 | |
| C. | 该氧化还原反应中氧化剂是Fe2O42-,发生氧化反应 | |
| D. | 有1mol还原剂参与反应时,转移4NA个电子 |
5.氯化铵晶体溶于重水中,生成物的化学式为( )
| A. | NH2D•H2O | B. | NH3•DHO | C. | HD2O+ | D. | NH3•D2O |
2.下列各组物质在溶液中反应时,以任意量混合均能用同一离子方程式表示的是( )
| A. | Ca(HCO3)2溶液和Ca(OH)2溶液 | B. | NaHCO3溶液和Ca(OH)2溶液 | ||
| C. | Na2CO3溶液和稀盐酸 | D. | Na和稀盐酸 |
9.下列叙述正确的是( )
| A. | 过氧化钠与足量的CO2气体反应转移1mole-时增重的质量为28g | |
| B. | 碳酸钠的碱性较弱,可用作治疗胃酸过多的药物 | |
| C. | 生活中的“高钙牛奶”、“加铁酱油”中的钙和铁指的是钙离子和亚铁离子 | |
| D. | 氯化铝坩埚可用来熔融碳酸钠固体 |
19.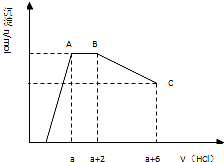 某溶液中可能含有OH-,CO32-,AlO2-,SiO32-,SO42-,K+,Na+,Fe3+,Mg2+,Al3+等离子,当向溶液中逐滴加入盐酸时,生成沉淀物质的量与加入盐酸体积的关系如图所示(已知::AlO2-+HCO3-+H2O=Al(OH)3↓+CO32-)),下列结论不正确的是( )
某溶液中可能含有OH-,CO32-,AlO2-,SiO32-,SO42-,K+,Na+,Fe3+,Mg2+,Al3+等离子,当向溶液中逐滴加入盐酸时,生成沉淀物质的量与加入盐酸体积的关系如图所示(已知::AlO2-+HCO3-+H2O=Al(OH)3↓+CO32-)),下列结论不正确的是( )
 某溶液中可能含有OH-,CO32-,AlO2-,SiO32-,SO42-,K+,Na+,Fe3+,Mg2+,Al3+等离子,当向溶液中逐滴加入盐酸时,生成沉淀物质的量与加入盐酸体积的关系如图所示(已知::AlO2-+HCO3-+H2O=Al(OH)3↓+CO32-)),下列结论不正确的是( )
某溶液中可能含有OH-,CO32-,AlO2-,SiO32-,SO42-,K+,Na+,Fe3+,Mg2+,Al3+等离子,当向溶液中逐滴加入盐酸时,生成沉淀物质的量与加入盐酸体积的关系如图所示(已知::AlO2-+HCO3-+H2O=Al(OH)3↓+CO32-)),下列结论不正确的是( )| A. | 溶液中一定不存在的离子:Fe3+,Mg2+,Al3+ | |
| B. | AB段可得到能使澄清的石灰水变浑浊的气体 | |
| C. | c(CO32-):c(AlO2-)=2:3 | |
| D. | BC段发生反应的离子方程式为Al(OH)3+3H+═Al3++3H2O |
4.用NaCl固体配制100mL2.00mol•L-1NaCl溶液,不需要用到的仪器是( )
| A. | 100mL容量瓶 | B. | 量筒 | C. | 玻璃棒 | D. | 烧杯 |