题目内容
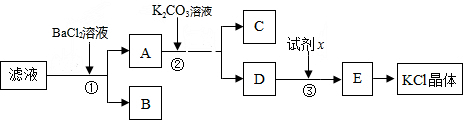
18.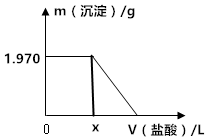 某固体混合物中含有Na2CO3、NaOH、BaCl2.现将3.940g该固体混合物溶于足量水中,结果得到1.970g沉淀;向反应后的试管中逐滴滴加0.5000mol/L的盐酸,加入盐酸的体积和沉淀质量的变化如图所示.
某固体混合物中含有Na2CO3、NaOH、BaCl2.现将3.940g该固体混合物溶于足量水中,结果得到1.970g沉淀;向反应后的试管中逐滴滴加0.5000mol/L的盐酸,加入盐酸的体积和沉淀质量的变化如图所示.(1)混合物中BaCl2的质量至少为2.08g.
(2)X的最大值为0.04L.
分析 (1)生成沉淀的反应为BaCl2+Na2CO3=BaCO3↓+2NaCl,则1.970g沉淀为碳酸钡,根据n=$\frac{m}{M}$计算出碳酸钡沉淀物质的量,然后结合反应可知氯化钡的物质的量,最高价m=nM计算出氯化钡的最少质量;
(2)0-x段碳酸钡沉淀没有溶解,能够与盐酸反应的有Na2CO3、NaOH,结合二者与HCl反应的质量关系判断需要HCl的最大量,然后根据V=$\frac{n}{c}$计算需要盐酸的最大体积.
解答 解:(1)1.970g沉淀为BaCO3,其物质的量为:n(BaCO3)=$\frac{1.970g}{197g/mol}$=0.01mol,根据反应BaCl2+Na2CO3=BaCO3↓+2NaCl可知,混合物中BaCl2的五子登科至少为0.01mol,质量为:208g/mol×0.01mol=2.08g,
故答案为:2.08;
(2)生成0.01mol BaCO3沉淀消耗Na2CO3的物质的量为0.01mol,质量为:106g/mol×0.01mol=1.06g,则生成1.970g碳酸钡沉淀消耗氯化钡、碳酸钠的总质量为:1.06g+2.08g=3.14g,没有参与反应的固体质量为:3.940g-3.14g=0.8g,
根据图象可知,x为剩余碳酸钠或NaOH消耗盐酸体积,
NaOH~HCl $\frac{1}{2}$Na2CO3~HCl
40g 1mol 53g 1mol
根据分析可知,固体质量一定是NaOH消耗盐酸的量较大,所以0.8g固体完全为NaOH时x有最大值,此时消耗HCl的最大物质的量为:n(HCl)=n(NaOH)=$\frac{0.8g}{40g/mol}$=0.02mol,需要0.5000mol/L的盐酸体积为:$\frac{0.02mol}{0.5000mol/L}$=0.04L,即x的最大值为0.04,
故答案为:0.04.
点评 本题考查了混合物反应的计算,题目难度中等,明确发生反应原理为解答关键,注意熟练掌握物质的量与more质量、物质的量浓度等之间的关系,试题培养了学生的分析能力及化学计算能力.

 百年学典课时学练测系列答案
百年学典课时学练测系列答案 仁爱英语同步练习册系列答案
仁爱英语同步练习册系列答案| A. | CH3Cl,CH2Cl2,CHCl3水解的最终产物都是CH3OH | |
| B. | 将溴苯加入到AgNO3溶液中,立即有淡黄色沉淀生成 | |
| C. | 1,2-二溴乙烷在NaOH的水溶液中共热可得到乙二醇 | |
| D. | 卤代烃的密度有的比水大,有的比水小 |
| A. | 过氧化钠与足量的CO2气体反应转移1mole-时增重的质量为28g | |
| B. | 碳酸钠的碱性较弱,可用作治疗胃酸过多的药物 | |
| C. | 生活中的“高钙牛奶”、“加铁酱油”中的钙和铁指的是钙离子和亚铁离子 | |
| D. | 氯化铝坩埚可用来熔融碳酸钠固体 |
| 分子式 | 结构简式 | 外观 | 熔点 | 溶解性 |
| C12H10ClN3O |  | 白色结晶粉末 | 170~ 172℃ | 易溶 于水 |
(1)氯吡苯脲晶体中,氮原子的杂化轨道类型为sp3、sp2杂化.
(2)氯吡苯脲晶体中,微粒间的作用力类型有BCD.
A.离子键 B.极性键 C.非极性键 D.配位键 E.氢键.
| A. | 0.5mol•L-1 | B. | 1mol•L-1 | C. | 1.5mol•L-1 | D. | 2mol•L-1 |