题目内容
11.标准状况下,乙烷和乙炔的混合气体2.24L通过足量溴水,溴水增重了0.26g,求此时混合气体中各组分的体积分数.分析 乙烷不与溴水反应,溴水增重的质量为乙炔的质量,根据n=$\frac{m}{M}$计算出乙烯的物质的量,再根据V=nVm计算出乙炔在标况下的体积,然后计算出混合气体中乙炔的体积分数.
解答 解:标准状况下,2.24L 乙烷和乙炔的混合气体缓慢通入足量溴水中,溴水增重0.26g,
由于乙烷不与溴水反应,则溴水增重的质量为乙炔的质量,即混合气体中乙烯的质量为0.26g,
混合气体中乙炔的物质的量为:$\frac{0.26g}{26g/mol}$=0.01mol,
标况下0.1mol 乙炔的体积为:22.4L/mol×0.01mol=0.224L,
混合气体中乙炔的体积分数为:$\frac{0.224L}{2.24L}$×100%=10%,乙烷的体积分数为:1-10%=90%,
答:混合气体中乙炔的体积分数为10%,乙烷的体积分数为90%.
点评 本题考查了有关混合物的计算,题目难度不大,明确乙炔与乙烷的化学性质为解答关键,注意掌握物质的量与摩尔质量、气体摩尔体积的关系,试题侧重基础知识的考查,有利于培养学生的化学计算能力.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
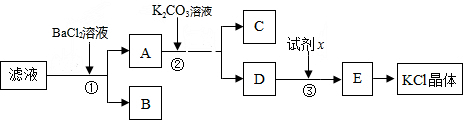
1. 常温下,向10mL0.1mol/L的HR溶液中逐滴滴人0.1mol/L的NH3•H2O溶液,所得溶液pH及导电性变化如图.下列分析正确的是( )
常温下,向10mL0.1mol/L的HR溶液中逐滴滴人0.1mol/L的NH3•H2O溶液,所得溶液pH及导电性变化如图.下列分析正确的是( )
 常温下,向10mL0.1mol/L的HR溶液中逐滴滴人0.1mol/L的NH3•H2O溶液,所得溶液pH及导电性变化如图.下列分析正确的是( )
常温下,向10mL0.1mol/L的HR溶液中逐滴滴人0.1mol/L的NH3•H2O溶液,所得溶液pH及导电性变化如图.下列分析正确的是( )| A. | a→b点导电能力增强,说明HR为弱酸 | |
| B. | b点溶液的pH=5,此时酸碱恰好中和 | |
| C. | c点溶液存在c(OH-)>c(H+) | |
| D. | a、b、c三点NH3•H2O的电离常数均相等 |
2.下列各组物质在溶液中反应时,以任意量混合均能用同一离子方程式表示的是( )
| A. | Ca(HCO3)2溶液和Ca(OH)2溶液 | B. | NaHCO3溶液和Ca(OH)2溶液 | ||
| C. | Na2CO3溶液和稀盐酸 | D. | Na和稀盐酸 |
19.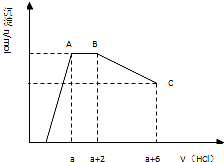 某溶液中可能含有OH-,CO32-,AlO2-,SiO32-,SO42-,K+,Na+,Fe3+,Mg2+,Al3+等离子,当向溶液中逐滴加入盐酸时,生成沉淀物质的量与加入盐酸体积的关系如图所示(已知::AlO2-+HCO3-+H2O=Al(OH)3↓+CO32-)),下列结论不正确的是( )
某溶液中可能含有OH-,CO32-,AlO2-,SiO32-,SO42-,K+,Na+,Fe3+,Mg2+,Al3+等离子,当向溶液中逐滴加入盐酸时,生成沉淀物质的量与加入盐酸体积的关系如图所示(已知::AlO2-+HCO3-+H2O=Al(OH)3↓+CO32-)),下列结论不正确的是( )
 某溶液中可能含有OH-,CO32-,AlO2-,SiO32-,SO42-,K+,Na+,Fe3+,Mg2+,Al3+等离子,当向溶液中逐滴加入盐酸时,生成沉淀物质的量与加入盐酸体积的关系如图所示(已知::AlO2-+HCO3-+H2O=Al(OH)3↓+CO32-)),下列结论不正确的是( )
某溶液中可能含有OH-,CO32-,AlO2-,SiO32-,SO42-,K+,Na+,Fe3+,Mg2+,Al3+等离子,当向溶液中逐滴加入盐酸时,生成沉淀物质的量与加入盐酸体积的关系如图所示(已知::AlO2-+HCO3-+H2O=Al(OH)3↓+CO32-)),下列结论不正确的是( )| A. | 溶液中一定不存在的离子:Fe3+,Mg2+,Al3+ | |
| B. | AB段可得到能使澄清的石灰水变浑浊的气体 | |
| C. | c(CO32-):c(AlO2-)=2:3 | |
| D. | BC段发生反应的离子方程式为Al(OH)3+3H+═Al3++3H2O |
16.常温下,关于pH=10的氨水和氢氧化钠溶液,下列说法正确的是( )
| A. | n(NH3•H2O)>n(NaOH) | |
| B. | 在氢氧化钠溶液中,c(OH)=1010mol/L | |
| C. | 在氨水中,c(OH)=c(NH4)+c(H) | |
| D. | 0.1mol/L的盐酸分别与等体积的氨水和氢氧化钠溶液恰好完全反应,氨水消耗的盐酸体积少 |
20.用如图所示的装置电解KBr溶液制取KBrO3,生成16.7g KBrO3时理论上转移电子的物质的量为( )

| A. | 0.1mol | B. | 0.2mol | C. | 0.4mol | D. | 0.6mol |
4.在新制饱和氯水中,若只改变某一条件,下列叙述正确的是( )
| A. | 再通入少量氯气,$\frac{c({H}^{+})}{c(Cl{O}^{-})}$减小 | |
| B. | 通入少量SO2,溶液漂白性增强 | |
| C. | 加入少量的碳酸钠粉末,pH增大,溶液漂白性增强 | |
| D. | 光照过程中,有气泡冒出,溶液的导电性减弱 |