题目内容
18.短周期元素X、Y、Z、W、Q在元素周期表中的位置如图所示,其中X元素原子最外层电子数是最内层电子数的3倍,则下列说法正确的是( )| X | Y | ||
| Z | W | Q |
| A. | X、W能与钠形成摩尔质量相同的化合物,且阴阳离子数比为1:2 | |
| B. | X和Z元素形成的化合物广泛应用于制造集成电路、太阳能电池板等 | |
| C. | 氧化物对应的水化物酸性:W<Q | |
| D. | 原子半径大小关系:Q>W>Z>Y |
分析 由短周期元素X、Z、W、Q在元素周期表中的位置,可知X、Y处于第二周期,Z、W、Q处于第三周期,其中X元素原子最外层电子数是最内层电子数的3倍,最外层电子数为6,故X为O元素,可推知Y为F元素、Z为Si、W为S、Q为Cl,以此来解答.
解答 解:由短周期元素X、Z、W、Q在元素周期表中的位置,可知X、Y处于第二周期,Z、W、Q处于第三周期,其中X元素原子最外层电子数是最内层电子数的3倍,最外层电子数为6,故X为O元素,可推知Y为F元素、Z为Si、W为S、Q为Cl,
A.O、S能与钠形成摩尔质量相同的化合物为Na2O2、Na2S,阳离子均为钠离子,且阴阳离子数比为1:2,故A正确;
B.含X和Z元素的常见化合物为SiO2,为光纤的材料,而Si为制造集成电路、太阳能电池板的材料,故B错误;
C.非金属性W(S)<Q(Cl),故最高价氧化物对应的水化物酸性:W<Q,故C错误;
D.同周期自左而右原子半径减小,同主族自上而下原子半径增大,故原子半径Z(Si)>W(S)>Q(Cl)>Y(F),故D错误;
故选A.
点评 本题考查位置、结构与性质,为高频考点,把握元素的位置、性质、元素周期律为解答的关键,侧重分析与应用能力的考查,注意X为O元素为解答的突破口,题目难度不大.

练习册系列答案
相关题目
8.下列根据实验现象所得出的结论中,正确的是( )
| A. | 向无色溶液加入盐酸酸化的氯化钡溶液有白色沉淀,结论:溶液中含有SO42- | |
| B. | 向无色溶液加入盐酸有气体产生,结论:溶液中有CO32- | |
| C. | 向无色试液加入硝酸银溶液产生白色沉淀,结论:溶液中含Cl-- | |
| D. | 向某溶液中加入氢氧化钠溶液加热,有氨气生成,结论:溶液中含有NH4+ |
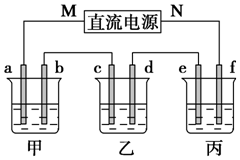 如图所示装置中,甲、乙、丙三个烧杯依次分别盛放100g 5.00%的NaOH溶液、足量的CuSO4溶液和100g 10.00%的K2SO4溶液,电极均为石墨电极.
如图所示装置中,甲、乙、丙三个烧杯依次分别盛放100g 5.00%的NaOH溶液、足量的CuSO4溶液和100g 10.00%的K2SO4溶液,电极均为石墨电极.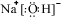 ,并指出其中存在的化学键.离子键和共价键
,并指出其中存在的化学键.离子键和共价键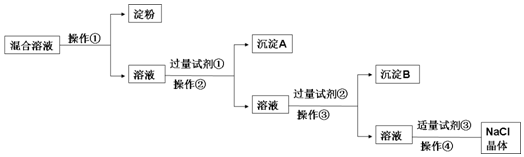
 蕊试液通过活性炭变成无色 D.用铂丝蘸取NaCl溶液进行焰色反应
蕊试液通过活性炭变成无色 D.用铂丝蘸取NaCl溶液进行焰色反应