题目内容
3.在2KMnO4+16HCl=2KCl+2MnCl2+5Cl2↑+8H2O反应中(1)该反应的氧化剂是KMnO4,氧化产物是Cl2
(2)该反应的离子方程式为2MnO4-+16H+=2Mn2++5Cl2↑+8H2O
(3)请用“双线桥法”标出该反应电子转移的方向和数目.
(4)该反应氧化剂与还原剂的物质的量之比为1:5.
分析 2KMnO4+16HCl(浓)═2KCl+2MnCl2+5Cl2↑+8H2O中Mn元素化合价降低,被还原,KMnO4为氧化剂,Cl元素化合价升高,被氧化,HCl为还原剂,以此解答.
解答 解:(1)2KMnO4+16HCl═2MnCl2+5Cl2↑+8H2O+2KCl中,Mn元素的化合价降低,KMnO4为氧化剂,Cl元素的化合价升高,被氧化,则氧化产物为Cl2,故答案为:KMnO4;Cl2;
(2)2KMnO4+16HCl(浓)═2KCl+2MnCl2+5Cl2↑+8H2O,离子方程式为:2MnO4-+16H+=2Mn2++5Cl2↑+8H2O,故答案为:2MnO4-+16H+=2Mn2++5Cl2↑+8H2O;
(3)2KMnO4+16HCl(浓)═2KCl+2MnCl2+5Cl2↑+8H2O中Mn元素化合价降低,被还原,KMnO4为氧化剂,Cl元素化合价升高,被氧化,HCl为还原剂,反应中Mn得到2×5e-,Cl失去10e-,电子转移数目和方向可表示 ,
,
故答案为: ;
;
(4)反应中,化合价升高是元素是盐酸中的氯元素,所以盐酸是还原剂,16mol的盐酸中只有10mol做还原剂,化合价降低的元素是锰元素,所以高锰酸钾是氧化剂,氧化剂与还原剂的物质的量比为1:5,故答案为:1:5.
点评 本题考查氧化还原反应,侧重于学生的分析能力的考查,为高频考点,注意把握元素化合价的变化,能会用双线桥法表示电子转移的方向和数目,难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
14.下列叙述中,正确的是( )
| A. | 铜和FeCl3溶液均能导电,但二者都不是电解质 | |
| B. | 分解反应的生成物中一定有单质 | |
| C. | 分散质粒子的直径在1×10-9~1×10-7cm之间的分散系属于胶体 | |
| D. | 氯气不能使干燥的有色布条褪色,液氯能使干燥的有色布条褪色 |
18.短周期元素X、Y、Z、W、Q在元素周期表中的位置如图所示,其中X元素原子最外层电子数是最内层电子数的3倍,则下列说法正确的是( )
| X | Y | ||
| Z | W | Q |
| A. | X、W能与钠形成摩尔质量相同的化合物,且阴阳离子数比为1:2 | |
| B. | X和Z元素形成的化合物广泛应用于制造集成电路、太阳能电池板等 | |
| C. | 氧化物对应的水化物酸性:W<Q | |
| D. | 原子半径大小关系:Q>W>Z>Y |
15.下列各组离子在溶液中能大量共存,加入强酸有气体放出,加入强碱有沉淀生成的一组是( )
| A. | Ca2+、K+、HCO3-、Cl- | B. | Fe3+、K+、SO42-、I- | ||
| C. | NH4+、Na+、CO32-、NO3- | D. | Cu2+、Na+、SO42-、Cl- |
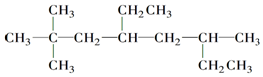 的名称为2,2,6-三甲基-4-乙基辛烷.
的名称为2,2,6-三甲基-4-乙基辛烷.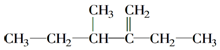 的名称为2-乙基-3-甲基-1-戊稀.
的名称为2-乙基-3-甲基-1-戊稀.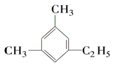 的名称为1,3-二甲基-5-乙基苯.
的名称为1,3-二甲基-5-乙基苯.
 .
. HCl溶液的pH=____________;0.01 mol/L NaOH溶液的pH=______________;pH=11的CH3COONa溶液中由水电离产生的c(OH-) =___________。
HCl溶液的pH=____________;0.01 mol/L NaOH溶液的pH=______________;pH=11的CH3COONa溶液中由水电离产生的c(OH-) =___________。