题目内容
3.写出下列反应的离子方程式:(1)磷酸溶液与少量澄清石灰水反应H3PO4+2OH-=HPO4 2-+2H2O;
(2)磷酸溶液与过量澄清石灰水反应2H3PO4+3Ca2++6OH-=6H2O+Ca3(PO4)2↓.
分析 (1)少量石灰水发生H3PO4+Ca(OH)2=CaHPO4 +2H2O;
(2)过量石灰水发生2H3PO4+3Ca(OH)2=6H2O+Ca3(PO4)2↓.
解答 解:(1)磷酸溶液与少量澄清石灰水反应的离子反应为H3PO4+2OH-=HPO4 2-+2H2O,故答案为:H3PO4+2OH-=HPO4 2-+2H2O;
(2)磷酸溶液与过量澄清石灰水反应的离子反应为2H3PO4+3Ca2++6OH-=6H2O+Ca3(PO4)2↓,故答案为:2H3PO4+3Ca2++6OH-=6H2O+Ca3(PO4)2↓.
点评 本题考查离子反应方程式的书写,为高频考点,把握发生的反应及离子反应的书写方法为解答的关键,侧重分析与应用能力的考查,注意复分解反应的判断,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
13.X、Y、Z、W四种元素在周期表中相对位置如图,Y、Z质子数之和为21,下列说法正确的是( )
| X | Y | ||
| Z | W |
| A. | 常温下,四种元素单质中,全部是固体 | |
| B. | Z的阳离子与Y的阴离子电子层结构相同 | |
| C. | X的气态氢化物比Y的气态氢化物稳定 | |
| D. | W元素原子半径比Z元素原子半径大 |
14.下列关于苯的叙述中正确的是( )
| A. | 苯分子的结构中六个碳原子的连接方式是单双建交替组成的环状 | |
| B. | 苯中含有碳碳双键,所以苯属于烯烃 | |
| C. | 苯分子中6个碳碳化学键完全相同 | |
| D. | 苯可以与溴水、高锰酸钾溶液反应而使它们褪色 |
11.下列电子式书写正确的是( )
| A. | 氯化钠 | B. | 氨气 | C. | NH4Cl的电子式  | D. | 硫化钠 |
18.有机物M可用于合成香料,其结构简式如图所示.下列有关说法不正确的是( )
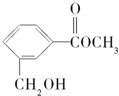

| A. | 有机物M中有2种含氧官能团 | |
| B. | 1mol有机物M可与1mol NaOH发生反应 | |
| C. | 有机物M能与溴水发生加成反应 | |
| D. | 1mol有机物M最多能与3mol H2反应 |
8.下列实验操作正确的是( )
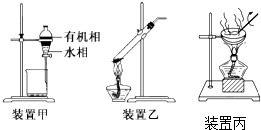

| A. | 用玻璃棒蘸取CH3COOH溶液点在水湿润的pH试纸上,测定该溶液的pH | |
| B. | 用装置甲分液,放出水相后再从分液漏斗上口放出有机相 | |
| C. | 用装置乙加热分解NaHCO3固体 | |
| D. | 用装置丙加热硫酸铜溶液获得CuSO45H2O |
15.X酯完全燃烧生成CO2和水的物质的量之比为1:1,X经过水解得B和C,C氧化可得到B,则X酯为( )
| A. | CH3COOCH2CH2CH3 | B. | CH3CH2COOCH2CH3 | ||
| C. | CH3COOCH2CH3 | D. | CH3CH2COOCH2CH=CH2 |
1.如表是元素周期表的一部分,针对表中元素,填写下列空白.
(1)Al3+的结构示意图为 .
.
(2)CO2中存在的化学键是共价键,CO2的电子式为 .
.
(3)上述元素中,金属性最强的元素是Na(填元素符号,下同),原子半径最小的元素是F.
(4)F、Cl、S的氢化物中稳定性最弱的是H2S(填化学式,下同).N、P、Si的最高价氧化物对应水化物中酸性最强的是HNO3.
(5)Na、Al最高价氧化物的水化物之间反应的化学方程式是NaOH+Al(OH)3=NaAlO2+2H2O.
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA |
| 2 | Li | Be | B | C | N | O | F |
| 3 | Na | Mg | Al | Si | P | S | Cl |
 .
.(2)CO2中存在的化学键是共价键,CO2的电子式为
 .
.(3)上述元素中,金属性最强的元素是Na(填元素符号,下同),原子半径最小的元素是F.
(4)F、Cl、S的氢化物中稳定性最弱的是H2S(填化学式,下同).N、P、Si的最高价氧化物对应水化物中酸性最强的是HNO3.
(5)Na、Al最高价氧化物的水化物之间反应的化学方程式是NaOH+Al(OH)3=NaAlO2+2H2O.