题目内容
15.X酯完全燃烧生成CO2和水的物质的量之比为1:1,X经过水解得B和C,C氧化可得到B,则X酯为( )| A. | CH3COOCH2CH2CH3 | B. | CH3CH2COOCH2CH3 | ||
| C. | CH3COOCH2CH3 | D. | CH3CH2COOCH2CH=CH2 |
分析 X完全燃烧生成CO2和水的物质的量之比为1:1,则X中C、H原子个数比为1:2;X经过水解得B和C,C氧化可得到B,则B、C中C原子个数相同,以此来解答.
解答 解:A.CH3COOCH2CH2CH3水解生成的乙酸和丙醇中C原子不同,不符合C氧化可得到B,故A不选;
B.CH3CH2COOCH2CH3水解生成丙酸和乙醇,不符合C氧化可得到B,故B不选;
C.C、H原子个数比为1:2,且水解生成乙酸和乙醇,符合题意,则X为CH3COOCH2CH3,故C选;
D.分子在含6个C,10个H,不符合完全燃烧生成CO2和水的物质的量之比为1:1,故D不选;
故选C.
点评 本题考查有机物的推断,为高频考点,把握官能团与性质的关系、有机反应等为解答的关键,侧重分析与应用能力的考查,注意酯、醇的性质及C、H原子个数关系,题目难度不大.

练习册系列答案
相关题目
5.在同温同压下,某有机物一定条件下,与碳酸氢钠、钠均能产生气体,且生成的气体体积比(同温同压)为1:1,则此有机物可能是( )
| A. | HOOCCOOH | B. | HOCH2CH2CH2COOH | C. | HOCH2CH2OH | D. | CH3COOH |
7.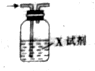 已知CO2通入澄清石灰水中,溶液先变浑浊,后又变澄清.用如图装置除去CO2气体中的HCl,X试剂最合适的是( )
已知CO2通入澄清石灰水中,溶液先变浑浊,后又变澄清.用如图装置除去CO2气体中的HCl,X试剂最合适的是( )
 已知CO2通入澄清石灰水中,溶液先变浑浊,后又变澄清.用如图装置除去CO2气体中的HCl,X试剂最合适的是( )
已知CO2通入澄清石灰水中,溶液先变浑浊,后又变澄清.用如图装置除去CO2气体中的HCl,X试剂最合适的是( )| A. | NaOH溶液 | B. | 浓硫酸 | C. | Na2CO3溶液 | D. | NaHCO3溶液 |
12.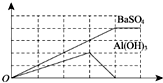 已知向溶液Q中滴加溶液P可生成两种沉淀,所得沉淀量与所加入的P溶液的体积关系如图所示,则Q、P分别为( )
已知向溶液Q中滴加溶液P可生成两种沉淀,所得沉淀量与所加入的P溶液的体积关系如图所示,则Q、P分别为( )
 已知向溶液Q中滴加溶液P可生成两种沉淀,所得沉淀量与所加入的P溶液的体积关系如图所示,则Q、P分别为( )
已知向溶液Q中滴加溶液P可生成两种沉淀,所得沉淀量与所加入的P溶液的体积关系如图所示,则Q、P分别为( )| A. | Q为NH4Al(SO4)2,P为Ba(OH)2 | B. | Q为Ba(OH)2,P为明矾 | ||
| C. | Q为明矾,P为Ba(OH)2 | D. | Q为Ba(AlO2)2,P为硫酸铝 |
13.某饱和一元醛发生银镜反应时可以析出21.6g银,等量的醛完全燃烧可以产生8.96LCO2(标准状况),则该醛为( )
| A. | 乙醛 | B. | 甲醛 | C. | 丙醛 | D. | 丁醛 |