题目内容
13.X、Y、Z、W四种元素在周期表中相对位置如图,Y、Z质子数之和为21,下列说法正确的是( )| X | Y | ||
| Z | W |
| A. | 常温下,四种元素单质中,全部是固体 | |
| B. | Z的阳离子与Y的阴离子电子层结构相同 | |
| C. | X的气态氢化物比Y的气态氢化物稳定 | |
| D. | W元素原子半径比Z元素原子半径大 |
分析 由X、Y、Z、W四种元素的位置可知,X、Y至少在第二周期,则Z、W在第三周期,Y、Z的质子数之差至少为8,结合Y、Z质子数之和为21可知X、Y只能位于第二周期、Z、W位于第三周期;设Y的原子序数为x,则Z的原子序数为x+5,Y、Z的质子数之和为21,则x+x+5=21,解得x=8,所以Y为O,W为S,Z为Al,X为C,然后结合元素及其单质、化合物的性质来解答.
解答 解:由X、Y、Z、W四种元素的位置可知,X、Y至少在第二周期,则Z、W在第三周期,Y、Z的质子数之差至少为8,结合Y、Z质子数之和为21可知X、Y只能位于第二周期、Z、W位于第三周期;设Y的原子序数为x,则Z的原子序数为x+5,Y、Z的质子数之和为21,则x+x+5=21,解得x=8,所以Y为O,W为S,Z为Al,X为C,
A.Y为O元素,其单质为氧气,在常温下为气体,故A错误;
B.Y为O、Z为Al,铝离子和氧离子核外电子总数都是10,二者核外电子排布相同,故B正确;
C.X为C、Y为O,非金属性C<O,则C的气态氢化物不如O的气态氢化物稳定,故C错误;
D.W为S、Z为Al,二者位于同一周期,原子序数越大,原子半径越小,则W(S)的原子半径小于Z(Al)的原子半径,故D错误;
故选B.
点评 本题考查了原子结构与元素周期律的应用,题目难度中等,推断元素为解答关键,明确元素周期律、元素周期表的结构为解答关键,试题有利于培养学生的灵活应用能力.

练习册系列答案
相关题目
3.某化学小组为测定一定质量的某铜铝混合物中铜的质量分数,设计了如下实验方案( )
方法Ⅰ:铜铝混合物$→_{充分反应}^{足量溶液A}$测定生成气体的体积
方法Ⅱ:铜铝混合物$→_{充分反应}^{足量B溶液}$测定剩余固体的质量.
方法Ⅰ:铜铝混合物$→_{充分反应}^{足量溶液A}$测定生成气体的体积
方法Ⅱ:铜铝混合物$→_{充分反应}^{足量B溶液}$测定剩余固体的质量.
| A. | 溶液A和溶液B均可以是盐酸或NaOH溶液 | |
| B. | 实验室中方案Ⅱ更便于实施 | |
| C. | 若溶液B选用浓硝酸,测得铜的质量分数偏大 | |
| D. | 方案一可能产生氢气,方案二可能剩余铜 |
1.碳酸钠晶体在加热时会失去全部结晶水,而碳酸钠本身不分解.
Na2CO3•xH2O $\stackrel{加热}{→}$ Na2CO3+x H2O
现有一种碳酸钠晶体(Na2CO3•xH2O),为了测定其组成,某学生在不同温度下给试样加热(温度逐次升高),实验结果记录如下:
坩埚质量32.500g;(坩埚+晶体试样)的质量55.700g.
(1)实验取用晶体样品的质量为23.2克,完全失去结晶水后固体质量为10.6克.
(2)计算确定碳酸钠晶体(Na2CO3•xH2O )中的x值.(写出计算过程)
Na2CO3•xH2O $\stackrel{加热}{→}$ Na2CO3+x H2O
现有一种碳酸钠晶体(Na2CO3•xH2O),为了测定其组成,某学生在不同温度下给试样加热(温度逐次升高),实验结果记录如下:
坩埚质量32.500g;(坩埚+晶体试样)的质量55.700g.
| 实验次数 | 温度(℃) | 冷却后(坩埚+试样)的质量(g) |
| 1 | T1 | 48.500 |
| 2 | T2 | 44.900 |
| 3 | T3 | 43.100 |
| 4 | T4 | 43.100 |
(2)计算确定碳酸钠晶体(Na2CO3•xH2O )中的x值.(写出计算过程)
18.下列说法正确的是( )
| A. | 含有双键的物质是烯烃 | B. | 烯烃是不饱和链烃 | ||
| C. | C4H8是烯烃 | D. | CH2=CHCH2OH是烯烃 |
5.在同温同压下,某有机物一定条件下,与碳酸氢钠、钠均能产生气体,且生成的气体体积比(同温同压)为1:1,则此有机物可能是( )
| A. | HOOCCOOH | B. | HOCH2CH2CH2COOH | C. | HOCH2CH2OH | D. | CH3COOH |
2.有一无色透明溶液,欲确定是否含有下列离子:K+、Mg2+、A13+、Ba2+、Fe2+、NO3-、SO42-、Cl-、I-、HCO3-.取该溶液实验如下:
由此判断:
(1)溶液中肯定存在的离子是NO3-、SO42- Mg2+、Al3+,溶液中肯定不存在的离子是I-、Ba2+、Fe2+、HCO3-,可能存在的离子是K+、Cl-
(2)如何检验溶液中是否有可能存在的阴离子 (写明操作、现象、结论)取少量原溶液加足量的硝酸钡溶液,过滤后,向滤液中加硝酸银溶液,有白色沉淀生成,再加稀硝酸,白色沉淀不溶解,说明有Cl-,反之则没有.
| 实验步骤 | 实现现象 |
| (1)取少量该溶液,加几滴甲基橙 | 溶液变红色 |
| (2)取少量该溶液加热浓缩,加Cu片和 浓H2SO4,加热 | 有无色气体产生,气体遇空气中以变成红棕色 |
| (3)取少量该溶液,加BaCl2溶液 | 有白色沉淀生成 |
| (4)取(3)中上层清液,加AgNO3溶液 | 有稳定的白色沉淀生成,且不溶于HNO3 |
| (5)取少量该溶液,加NaOH溶液 | 有白色沉淀生成,当NaOH过量时沉淀部分溶解 |
(1)溶液中肯定存在的离子是NO3-、SO42- Mg2+、Al3+,溶液中肯定不存在的离子是I-、Ba2+、Fe2+、HCO3-,可能存在的离子是K+、Cl-
(2)如何检验溶液中是否有可能存在的阴离子 (写明操作、现象、结论)取少量原溶液加足量的硝酸钡溶液,过滤后,向滤液中加硝酸银溶液,有白色沉淀生成,再加稀硝酸,白色沉淀不溶解,说明有Cl-,反之则没有.
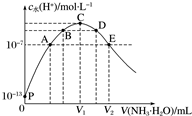 常温下向25mL盐酸中逐滴滴入0.1mol•L-1氨水,溶液中由水电离出的c水(H+)随滴入氨水的体积变化如图所示.
常温下向25mL盐酸中逐滴滴入0.1mol•L-1氨水,溶液中由水电离出的c水(H+)随滴入氨水的体积变化如图所示.