题目内容
相同物质的量的O2和O3一定具有相同的( )
| A、原子数 | B、分子数 |
| C、体积 | D、质量 |
考点:物质的量的相关计算
专题:计算题
分析:物质的量相等的氧气和臭氧,其分子数一定相等,再结合分子构成、m=nM分析解答.
解答:
解:A.物质的量相等的氧气和臭氧,根据N=nNA知,其分子数一定相等,根据其分子构成知,其原子个数之比为2:3,故A错误;
B.物质的量相等的氧气和臭氧,根据N=nNA知,其分子数一定相等,故B正确;
C.状况未知,不能利用物质的量计算其体积,若在相同状况下体积之比为1:1,故C错误;
D.根据m=nM知,相同物质的量时,其质量之比等于其摩尔质量之比=32g/mol:48g/mol=2:3,故D错误;
故选B.
B.物质的量相等的氧气和臭氧,根据N=nNA知,其分子数一定相等,故B正确;
C.状况未知,不能利用物质的量计算其体积,若在相同状况下体积之比为1:1,故C错误;
D.根据m=nM知,相同物质的量时,其质量之比等于其摩尔质量之比=32g/mol:48g/mol=2:3,故D错误;
故选B.
点评:本题考查了物质的量的计算,为考试热点,明确物质的量与体积、质量、微粒数之间的关系即可解答,易错选项是C,注意气体摩尔体积受温度和压强影响,为易错点.

练习册系列答案
相关题目
已知:
①2H2(g)+O2(g)═2H2O(g);△H=-483.6kJ/mol;
②H+(aq)+OH-(aq)═H2O(l);△H=-57.3kJ/mol;
下列说法中正确的是( )
①2H2(g)+O2(g)═2H2O(g);△H=-483.6kJ/mol;
②H+(aq)+OH-(aq)═H2O(l);△H=-57.3kJ/mol;
下列说法中正确的是( )
| A、由①式可知H2的燃烧热为241.8KJ/mol |
| B、2H2(g)+O2(g)═2H2O(l)△H>-483.6kJ/mol |
| C、将含1mol NaOH的稀溶液与0.05mol浓硫酸溶液混合后放出的热量为57.3kJ |
| D、将含1mol Ba(OH)2的稀溶液与含2molHCl的稀溶液混合后放出的热量等于114.6kJ |
下列各组物质中互称为同分异构体的是( )
| A、红磷与白磷 |
| B、水与重水 |
| C、乙醇(CH3CH2OH)与二甲醚(CH3OCH3) |
| D、O2与O3 |
下列分子中属于含极性键的非极性分子的是( )
| A、H2S |
| B、CH4 |
| C、Cl2 |
| D、NH3 |
根据元素周期表和元素周期律,下列推断中错误的是( )
| A、砹是一种有色固体,它的气态氢化物很不稳定 |
| B、F2与水反应比Cl2与水反应剧烈 |
| C、铷的硫酸盐易溶解于水,其氢氧化物一定是弱碱 |
| D、氯化氢比溴化氢稳定,HClO4酸性强于HBrO4 |
A、B、C、D、E是元素周期表中的短周期主族元素,且原子序数依次增大.已知A与B不在同周期,A与C同主族,B原子最外层电子数是其电子层数的2倍,A、C、E原子最外层电子数之和为6,D的氧化物具有两性.下列说法正确的是( )
| A、A、B只能形成一种化合物 |
| B、离子半径:C<D |
| C、气态氢化物的稳定性:B>E |
| D、元素C、D的最高价氧化物对应水化物之间不能发生反应 |
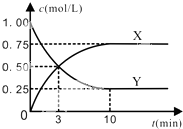 在一恒温、恒容密闭容器中充入1mol CO2和3mol H2,一定条件下发生反应:
在一恒温、恒容密闭容器中充入1mol CO2和3mol H2,一定条件下发生反应: