题目内容
 在一恒温、恒容密闭容器中充入1mol CO2和3mol H2,一定条件下发生反应:
在一恒温、恒容密闭容器中充入1mol CO2和3mol H2,一定条件下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ?mol-1
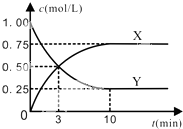
某种反应物和生成物的浓度随时间变化如图所示.
回答下列问题:
(1)Y的化学式是
(2)反应进行到3min时,v正
(3)不能判断该反应达到化学平衡状态的依据是
A.容器内各气体的体积比保持不变 B.混合气体密度不变
C.3v逆(CH3OH)=v正(H2) D.H2转化率为75%
(4)上述反应达到平衡后,往容器中同时加入1molCO2和1mol H2O(g),此时平衡将
(5)上述温度下,反应CH3OH(g)+H2O(g)?CO2(g)+3H2(g)的平衡常数K=
考点:物质的量或浓度随时间的变化曲线,反应速率的定量表示方法,化学平衡的影响因素,化学平衡状态的判断
专题:化学平衡专题
分析:(1)由图可知反应进行到3min时,消耗的Y和生成的X均为0.5mol,说明二者的计量数相同,根据方程式判断;
(2)反应进行到3min时,反应未到达平衡状态;根据二氧化碳的浓度变化求出氢气的浓度变化,再求反应速率;
(3)在一定条件下,当化学反应达到平衡状态时,正逆反应速率相等,各物质的浓度不变,由此衍生的一些物理量也不变;
(4)先计算出平衡常数K,再根据Qc与K的大小关系判断;
(5)正逆反应的平衡常数互为倒数关系.
(2)反应进行到3min时,反应未到达平衡状态;根据二氧化碳的浓度变化求出氢气的浓度变化,再求反应速率;
(3)在一定条件下,当化学反应达到平衡状态时,正逆反应速率相等,各物质的浓度不变,由此衍生的一些物理量也不变;
(4)先计算出平衡常数K,再根据Qc与K的大小关系判断;
(5)正逆反应的平衡常数互为倒数关系.
解答:
解:(1)由图可知反应进行到3min时,消耗的Y和生成的X均为0.5mol,说明二者的计量数相同,已知CO2(g)+3H2(g)?CH3OH(g)+H2O(g),
则反应物Y为CO2,故答案为:CO2;
(2)反应进行到3min时,反应未到达平衡状态,反应仍正向进行,所以v正>v逆;反应前3min,消耗的二氧化碳为1.00-0.50=0.50mol/L,则消耗的氢气为
0.50mol/L×3=1.50mol/L,则v(H2)=
=0.5mol?L-1?min-1,
故答案为:>;0.5;
(3)在一定条件下,当化学反应达到平衡状态时,正逆反应速率相等,各物质的浓度不变,
A.容器内各气体的体积比保持不变,说明各物质的量保持不变,所以证明已经达到平衡状态,故A正确;
B.混合气体的体积不变,质量守恒,所以混合气体的密度始终不变,所以不能证明已经达到平衡状态,故B错误;
C.达到平衡状态时,不同物质的反应速率之比等于计量数之比,即是平衡状态,所以3v逆(CH3OH)=v正(H2) 时,说明已经达到平衡状态,故C正确;
D.由图可知,达到平衡状态时二氧化碳转化了0.75mol/L,则H2转化了0.75mol/L×3=2.25mol/L,所以氢气的转化率为
×100%=75%,故D正确;
故答案为:B;
(4)由图可知,达到平衡状态时二氧化碳转化了0.75mol/L,则H2转化了0.75mol/L×3=2.25mol/L,生成的c(CH3OH)=c(H2O)=0.75mol/L;
则平衡时c(CO2)=0.25mol/L,c(H2)=0.75mol/L,c(CH3OH)=0.75mol/L,c(H2O)=0.75mol/L,
则K=
=
=5.33,往容器中同时加入1molCO2和1mol H2O(g),则Qc=
=2.49<K=5.33,则反应未到达平衡状态,所以反应向右进行,
故答案为:向右;
(5)反应CH3OH(g)+H2O(g)?CO2(g)+3H2(g)是反应CO2(g)+3H2(g)?CH3OH(g)+H2O(g)的逆反应,二者的平衡常数互为倒数的关系,则K′=
=
=0.19,故答案为:0.19.
则反应物Y为CO2,故答案为:CO2;
(2)反应进行到3min时,反应未到达平衡状态,反应仍正向进行,所以v正>v逆;反应前3min,消耗的二氧化碳为1.00-0.50=0.50mol/L,则消耗的氢气为
0.50mol/L×3=1.50mol/L,则v(H2)=
| 1.50mol/L |
| 3min |
故答案为:>;0.5;
(3)在一定条件下,当化学反应达到平衡状态时,正逆反应速率相等,各物质的浓度不变,
A.容器内各气体的体积比保持不变,说明各物质的量保持不变,所以证明已经达到平衡状态,故A正确;
B.混合气体的体积不变,质量守恒,所以混合气体的密度始终不变,所以不能证明已经达到平衡状态,故B错误;
C.达到平衡状态时,不同物质的反应速率之比等于计量数之比,即是平衡状态,所以3v逆(CH3OH)=v正(H2) 时,说明已经达到平衡状态,故C正确;
D.由图可知,达到平衡状态时二氧化碳转化了0.75mol/L,则H2转化了0.75mol/L×3=2.25mol/L,所以氢气的转化率为
| 2.25 |
| 3 |
故答案为:B;
(4)由图可知,达到平衡状态时二氧化碳转化了0.75mol/L,则H2转化了0.75mol/L×3=2.25mol/L,生成的c(CH3OH)=c(H2O)=0.75mol/L;
则平衡时c(CO2)=0.25mol/L,c(H2)=0.75mol/L,c(CH3OH)=0.75mol/L,c(H2O)=0.75mol/L,
则K=
| c(CH3OH)?c(H2O) |
| c(CO2)?c3(H2) |
| 0.75×0.75 |
| 0.25×0.753 |
| 0.75×(1+0.75) |
| (0.25+1)×0.753 |
故答案为:向右;
(5)反应CH3OH(g)+H2O(g)?CO2(g)+3H2(g)是反应CO2(g)+3H2(g)?CH3OH(g)+H2O(g)的逆反应,二者的平衡常数互为倒数的关系,则K′=
| 1 |
| K |
| 1 |
| 5.33 |
点评:本题考查反应速率计算、化学平衡的计算与影响因素、平衡常数的计算、反应方向的判断等,题目涉及的知识点较多,难度中等,侧重于考查学生分析和解决问题的能力.

练习册系列答案
相关题目
下列各组离子能在呈酸性的无色溶液中大量共存的是( )
| A、Ba2+、Na+、NO3-、Cl- |
| B、Ca2+、Na+、Fe3+、SO32- |
| C、K+、OH-、HCO3-、NO3- |
| D、Mg2+、Cl-、Al3+、SO42- |
下列说法中正确的是( )
| A、离子化合物中不可能含有共价键 |
| B、含有共价键的化合物就是共价化合物 |
| C、共价化合物可能含离子键 |
| D、含有离子键的化合物必是离子化合物 |
相同物质的量的O2和O3一定具有相同的( )
| A、原子数 | B、分子数 |
| C、体积 | D、质量 |

 电解原理在化学工业中有广泛应用.如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.请完成以下问题:
电解原理在化学工业中有广泛应用.如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.请完成以下问题: A~E五种物质间的相互转化关系如图所示,其中A为单质,B为淡黄色的固体.试推断:(用化学式表示)
A~E五种物质间的相互转化关系如图所示,其中A为单质,B为淡黄色的固体.试推断:(用化学式表示)
 (1)如图所示为过氧化氢在
(1)如图所示为过氧化氢在