题目内容
9.电解法处理酸性含铬废水(主要含有Cr2O72-)时,以铁板作阴、阳极,处理过程中存在反应:Cr2O72-+6Fe2++14H+═2Cr3++6Fe3++7H2O,最后Cr3+以Cr(OH)3形式除去,下列说法不正确的是( )| A. | 阳极反应为:Fe-2e-═Fe2+ | B. | 电解过程中pH不变 | ||
| C. | 过程中有Fe(OH)3生成 | D. | 上述反应中Cr2O72-被还原 |
分析 以铁板作阴、阳极,阳极发生Fe-2e-═Fe2+,发生Cr2O72-+6Fe2++14H+═2Cr3++6Fe3++7H2O,阴极生成氢氧根离子,进而生成Cr(OH)3、Fe(OH)3,以达到除去重金属离子的目的,以此解答该题.
解答 解:A.Fe板作阳极,为活性电极,Fe失电子,发生氧化反应生成亚铁离子,阳极反应为Fe-2e-═Fe2+,故A正确;
B.由反应式Cr2O72-+6Fe2++14H+═2Cr3++6Fe3++7H2O可知,处理过程中消耗氢离子,溶液的酸性减弱,溶液pH增大,故B错误;
C.阴极发生还原反应,溶液中的氢离子得到电子减少,同时生成氢氧根,有Fe(OH)3沉淀生成,故C正确;
D.反应中Cr元素化合价由+6价降低到+3价,则反应中Cr2O72-被还原,故D正确.
故选B.
点评 本题考查电解原理、氧化还原反应等,为高频考点,清楚发生的电极反应是解题的关键,是对学生综合能力的考查,难度中等.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
17.下列反应的离子方程式书写不正确的是( )
| A. | 淀粉碘化钾溶液加酸后变蓝:4I-+O2+4H+═2I2+2H2O | |
| B. | 向FeCl3溶液中加入Mg(OH)2:3Mg(OH)2+2Fe3+═2Fe(OH)3+3Mg2+ | |
| C. | 在Fe(NO3)2和KI组成的混合溶液中滴入少量稀盐酸:3Fe2++4H++NO3-═3Fe3++NO↑+2H2O | |
| D. | 向NH4Fe(SO4)2溶液中逐滴加入Ba(OH)2溶液,可能发生的反应是:NH4++Fe3++2SO42-+2Ba2++4OH-═2BaSO4↓+NH3•H2O+Fe(OH)3↓ |
4.全世界各国运动会上都禁止运动员服用兴奋剂,这是保证公正公平的基本要求;如图是某种兴奋剂的结构简式,有关该物质的说法正确的是 ( )

| A. | 该分子中所有碳原子一定都在一个平面上 | |
| B. | 该分子遇FeCl3溶液显紫色,但与苯酚不属于同系物 | |
| C. | 1mol该物质与浓溴水和H2反应时,最多消耗Br2和H2的物质的量分别为4mol、7mol | |
| D. | 滴入酸性KMnO4溶液,观察到紫色褪去,可证明分子中存在双键. |
14.下列叙述正确的是( )
| A. | 甲苯既可使溴的四氯化碳溶液褪色,也可使酸性高锰酸钾溶液褪色 | |
| B. | 有机物  的消去(分子内脱水)产物只有2种 的消去(分子内脱水)产物只有2种 | |
| C. | 有机物A(C4H6O2)能发生加聚反应,可推知A的结构一定是CH2═CH-COOCH3 | |
| D. | 可用溴水鉴别已烯、四氯化碳和乙酸 |
14.室温下某溶液的pH=12,则在该溶液中,由水电离出的OH-的浓度可能是( )
| A. | 1×10-5mol/L | B. | 1×10-12mol/L | C. | 1×10-6mol/L | D. | 1×10-7mol/L |
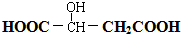 . 请回答:
. 请回答: .
.