题目内容
14.室温下某溶液的pH=12,则在该溶液中,由水电离出的OH-的浓度可能是( )| A. | 1×10-5mol/L | B. | 1×10-12mol/L | C. | 1×10-6mol/L | D. | 1×10-7mol/L |
分析 室温下某溶液的pH=12,溶液呈碱性,溶液可能为碱溶液,或为水解呈碱性的盐溶液,其中碱溶液中水的电离受到抑制,而盐的水解促进水的电离,以此解答该题.
解答 解:室温下某溶液的pH=12,溶液呈碱性,溶液可能为碱溶液,或为水解呈碱性的盐溶液,
如为碱溶液,水的电离受到抑制,c(OH-)=1×10-12mol/L,
如为盐溶液,促进水的电离,c(OH-)=1×10-2mol/L,
故选B.
点评 本题涉及pH的简单计算,侧重于学生的分析、计算能力的考查,注意把握水的电离影响因素以及盐类水解的特点,题目难度中等.

练习册系列答案
 灵星计算小达人系列答案
灵星计算小达人系列答案 孟建平错题本系列答案
孟建平错题本系列答案
相关题目
9.电解法处理酸性含铬废水(主要含有Cr2O72-)时,以铁板作阴、阳极,处理过程中存在反应:Cr2O72-+6Fe2++14H+═2Cr3++6Fe3++7H2O,最后Cr3+以Cr(OH)3形式除去,下列说法不正确的是( )
| A. | 阳极反应为:Fe-2e-═Fe2+ | B. | 电解过程中pH不变 | ||
| C. | 过程中有Fe(OH)3生成 | D. | 上述反应中Cr2O72-被还原 |
2.硫酸锌可作为食品锌强化剂的原料.工业上常用菱锌矿生产硫酸锌,菱锌矿的主要成分是ZnCO3,并含少量的Fe2O3、FeCO3、MgO、CaO等,生产工艺流程示意图如下:

(1)将菱锌矿研磨成粉的目的是增大反应物接触面积或增大反应速率或使反应更充分.
(2)完成“氧化除铁”步骤中反应的离子方程式:
□Fe(OH)2+□1ClO-+□1H2O═□Fe(OH)3+□Cl-
(3)针铁矿(Coethite)是以德国诗人歌德(Coethe)名字命名的,组成元素是Fe、O和H,化学式量为89,化学式是FeO(OH).
(4)根据下表数据,调节“滤液 2”的pH时,理论上可选用的最大区间为8.0≤pH<10.4.
(5)工业上从“滤液3”制取MgO过程中,合适的反应物是b或d(选填序号).
a.大理石粉 b.石灰乳c.纯碱溶液 d.烧碱溶液
(6)“滤液4”之后的操作依次为蒸发浓缩、冷却结晶、过滤、洗涤、干燥.
(7)分析图中数据,菱锌矿粉中ZnCO3 的质量分数不低于$\frac{125m{\;}_{2}}{81m{\;}_{1}}$×100%.

(1)将菱锌矿研磨成粉的目的是增大反应物接触面积或增大反应速率或使反应更充分.
(2)完成“氧化除铁”步骤中反应的离子方程式:
□Fe(OH)2+□1ClO-+□1H2O═□Fe(OH)3+□Cl-
(3)针铁矿(Coethite)是以德国诗人歌德(Coethe)名字命名的,组成元素是Fe、O和H,化学式量为89,化学式是FeO(OH).
(4)根据下表数据,调节“滤液 2”的pH时,理论上可选用的最大区间为8.0≤pH<10.4.
| Mg(OH)2 | Zn(OH)2 | MgCO3 | CaCO3 | |
| 开始沉淀的pH | 10.4 | 6.4 | - | - |
| 沉淀完全的pH | 12.4 | 8.0 | - | - |
| 开始溶解的pH | - | 10.5 | - | - |
| Ksp | 5.6×10-12 | - | 6.8×10-6 | 2.8×10-9 |
a.大理石粉 b.石灰乳c.纯碱溶液 d.烧碱溶液
(6)“滤液4”之后的操作依次为蒸发浓缩、冷却结晶、过滤、洗涤、干燥.
(7)分析图中数据,菱锌矿粉中ZnCO3 的质量分数不低于$\frac{125m{\;}_{2}}{81m{\;}_{1}}$×100%.
9. X、Y、Z、W是元素周期表前四周期中的四种常见元素,其相关信息如下表:
X、Y、Z、W是元素周期表前四周期中的四种常见元素,其相关信息如下表:
(1)Y位于元素周期表第三周期第VIA族,Y和Z的最高价氧化物对应的水化物的酸性较强的是HClO4(写化学式).
(2)XY2是一种常用的溶剂,XY2的分子中存在2个σ键.在H-Y、H-Z两种共价键中,键的极性较强的是H-Cl,键长较长的是H-S.
(3)W的基态原子价电子排布式是3d104s1.
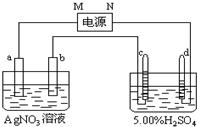
工业上以W2Y为原料制备W的化学方程式为Cu2S+2O2$\frac{\underline{\;高温\;}}{\;}$2Cu+2SO2 ,通过该方法冶炼得到的W的单质含有锌、铁、镍、银、金等杂质,除去这些杂质常用的方法叫电解精炼,请标出右图所示装置中电极材料名称及电解质溶液名称.
(4)W形成的氧化物W2O为半导体材料,在其立方晶胞内部有4个氧原子,其余氧原子位于面心和顶点,则该晶胞中有16个W原子.
 X、Y、Z、W是元素周期表前四周期中的四种常见元素,其相关信息如下表:
X、Y、Z、W是元素周期表前四周期中的四种常见元素,其相关信息如下表:| 元素 | 相关信息 |
| X | X的基态原子核外3个能级上有电子,且每个能级上的电子数相等 |
| Y | 常温常压下,Y单质是淡黄色固体,常在火山口附近沉积 |
| Z | Z和Y同周期,Z的电负性大于Y |
| W | W的一种核素的质量数为63,中子数为34 |
(2)XY2是一种常用的溶剂,XY2的分子中存在2个σ键.在H-Y、H-Z两种共价键中,键的极性较强的是H-Cl,键长较长的是H-S.
(3)W的基态原子价电子排布式是3d104s1.
工业上以W2Y为原料制备W的化学方程式为Cu2S+2O2$\frac{\underline{\;高温\;}}{\;}$2Cu+2SO2 ,通过该方法冶炼得到的W的单质含有锌、铁、镍、银、金等杂质,除去这些杂质常用的方法叫电解精炼,请标出右图所示装置中电极材料名称及电解质溶液名称.
(4)W形成的氧化物W2O为半导体材料,在其立方晶胞内部有4个氧原子,其余氧原子位于面心和顶点,则该晶胞中有16个W原子.
4.关乙烯的说法,其中错误的是( )
| A. | 乙烯分子的双键中有一个键较易断裂 | |
| B. | 乙烯分子里所有原子都在同一平面上,且碳氢键之间的键角为120° | |
| C. | 乙烯分子中2个碳原子都是sp2杂化,乙烯分子有5个σ键 | |
| D. | 乙烯和环丙烷(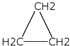 )的分子组成符合通式CnH2n,因此它们属于同系物 )的分子组成符合通式CnH2n,因此它们属于同系物 |
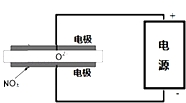 2015年8月12日天津港特大爆炸事故,再一次引发了人们对环境问题的关注.据查危化仓库中存有大量的钠、钾、白磷(P4)、硝酸铵和氰化钠(NaCN).
2015年8月12日天津港特大爆炸事故,再一次引发了人们对环境问题的关注.据查危化仓库中存有大量的钠、钾、白磷(P4)、硝酸铵和氰化钠(NaCN). .
.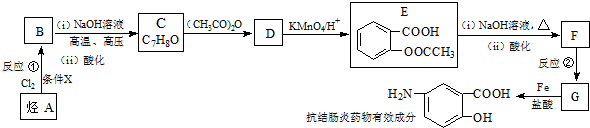
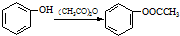
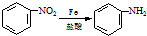
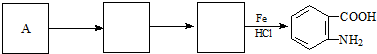
 ;反应①的反应条件是FeCl3作催化剂;反应②的反应类型是取代反应;
;反应①的反应条件是FeCl3作催化剂;反应②的反应类型是取代反应; ;
;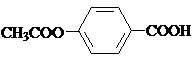 ,
, ;
;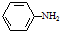 )易被氧化,苯环上连有烷基时再引入一个取代基,常取代在烷基的邻对位,而当苯环上连有羧基时则取代在间位.据此按先后顺序写出以A为原料合成邻氨基苯甲酸(
)易被氧化,苯环上连有烷基时再引入一个取代基,常取代在烷基的邻对位,而当苯环上连有羧基时则取代在间位.据此按先后顺序写出以A为原料合成邻氨基苯甲酸(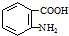 )合成路线中两种中间产物的结构简式(部分反应条件已略去)
)合成路线中两种中间产物的结构简式(部分反应条件已略去)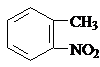 ,
,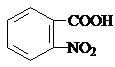 .
.