题目内容
20.A是一种强酸,其浓度超过40%时就会迅速分解,产生比它的酸性更强的酸B,同时放出单质气体C和D,该气体经干燥后,气体C和D的体积比为2:3,所得气体通过80℃NaOH溶液,得到的产物中一种是A的钠盐,同时还剩余一种可以使带火星的木条复燃的气体D.试完成下列各题:(1)确定各物质的化学式AHClO3、BHClO4、CCl2;
(2)写出A分解方程式并配平;8HClO3=4HClO4+3O2↑+2Cl2↑+2H2O;
(3)写出气体C与湿润的淀粉-碘化钾试纸的反应方程式Cl2+2KI=2KCl+I2;
(4)写出将气体C通过80℃NaOH溶液时发生的反应方程式3Cl2+6NaOH$\frac{\underline{\;\;△\;\;}}{\;}$5NaCl+NaClO3+3H2O.
分析 可以使带火星的木条复燃的气体D为O2,C可与氢氧化钠溶液反应生成A的钠盐,且A可分解可生成C和氧气,说明C的化合价有多种,对应的酸为强酸,可分别,应为Cl元素,可知A应为HClO3,B为HClO4,生成C为Cl2,以此解答该题.
解答 解:可以使带火星的木条复燃的气体D为O2,C可与氢氧化钠溶液反应生成A的钠盐,且A可分解可生成C和氧气,说明C的化合价有多种,对应的酸为强酸,可分别,应为Cl元素,可知A应为HClO3,B为HClO4,生成C为Cl2,
(1)由以上分析可知A为HClO3,B为HClO4,C为Cl2,故答案为:HClO3;HClO4;Cl2;
(2)根据氧化还原反应过程中得失电子守恒可以确定HClO4的化学计量数.由解析(1)及题意可知,氯酸分解的化学方程式为:(a+4)HClO3=aHClO4+3O2↑+2Cl2↑+2H2O,根据得失电子守恒有:a×2+2×2×3=5×2×2,得a=4.因此配平的化学方程式为:8HClO3=4HClO4+3O2↑+2Cl2↑+2H2O;
故答案为:8HClO3=4HClO4+3O2↑+2Cl2↑+2H2O;
(3)该气体混合物与湿润的淀粉碘化钾试纸作用,C与湿润的淀粉-碘化钾试纸的反应的化学方程式分别为:Cl2+2KI=2KCl+I2;
故答案为:Cl2+2KI=2KCl+I2;
(4)将该气体混合物通过80℃NaOH溶液,这时Cl2与热的烧碱溶液发生反应:3Cl2+6NaOH$\frac{\underline{\;\;△\;\;}}{\;}$5NaCl+NaClO3+3H2O;
故答案为:3Cl2+6NaOH$\frac{\underline{\;\;△\;\;}}{\;}$5NaCl+NaClO3+3H2O.
点评 本题考查无机物的推断,为高频考点,侧重于学生的分析能力的考查,注意把握物质的性质以及反应的现象,题目难度不大.

| A. | 青蒿素分子式为C15H20O5 | |
| B. | 可用蒸馏水提取植物中的青蒿素 | |
| C. | 青蒿素在碱性条件下易发生水解反应 | |
| D. | 青蒿素遇湿润的淀粉碘化钾试纸立刻显蓝色,是因为分子结构中含有酯基 |
| A. | 稀硫酸与氢氧化钡溶液反应 | B. | 稀硝酸与烧碱溶液反应 | ||
| C. | 醋酸与氢氧化钾溶液反应 | D. | 盐酸与氢氧化铁反应 |
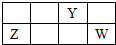 短周期元素X、Y、Z、W的原子序数依次增大,X、Y原子最外层电子数之和等于W原子最外层电子数,Y、Z的最高正化合价之和为8.部分元素在周期表中的相对位置如右图所示.下列说法中正确的是( )
短周期元素X、Y、Z、W的原子序数依次增大,X、Y原子最外层电子数之和等于W原子最外层电子数,Y、Z的最高正化合价之和为8.部分元素在周期表中的相对位置如右图所示.下列说法中正确的是( )| A. | ZY晶体熔化、ZCl3溶于水破坏的化学键种类相同 | |
| B. | 化合物YCl3水解产物之一具有强氧化性,由此可知Y在该化合物中的化合价为+3 | |
| C. | 元素R与W同主族,且原子序数小于W.因为R的非金属性强于W,所以X2R的沸点高于X2W | |
| D. | Z2W3固体可由溶液中复分解反应制得 |
| A. | 乙烯(SO2、H2O):碱石灰,洗气 | B. | 乙烷(乙烯):酸性 KMnO4,洗气 | ||
| C. | 炭粉(MnO2):热的浓盐酸,过滤 | D. | Cl2(HCl):饱和食盐水,洗气 |
| A. | CO2、SO2、NH3都是直线形分子 | |
| B. | CO2、NH3、H2S 的键角依次减小 | |
| C. | H2O2、N2H4分子的中心原子都是 sp3杂化 | |
| D. | C、N、F元素的电负性依次增大 |
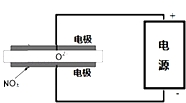
| A. | 阳极反应为:Fe-2e-═Fe2+ | B. | 电解过程中pH不变 | ||
| C. | 过程中有Fe(OH)3生成 | D. | 上述反应中Cr2O72-被还原 |
 2015年8月12日天津港特大爆炸事故,再一次引发了人们对环境问题的关注.据查危化仓库中存有大量的钠、钾、白磷(P4)、硝酸铵和氰化钠(NaCN).
2015年8月12日天津港特大爆炸事故,再一次引发了人们对环境问题的关注.据查危化仓库中存有大量的钠、钾、白磷(P4)、硝酸铵和氰化钠(NaCN).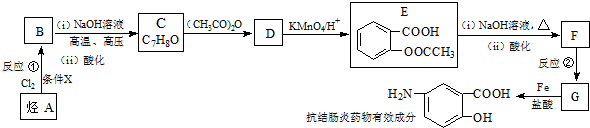
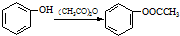
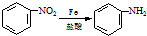
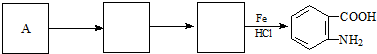
 ;反应①的反应条件是FeCl3作催化剂;反应②的反应类型是取代反应;
;反应①的反应条件是FeCl3作催化剂;反应②的反应类型是取代反应; ;
;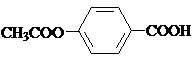 ,
, ;
;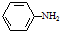 )易被氧化,苯环上连有烷基时再引入一个取代基,常取代在烷基的邻对位,而当苯环上连有羧基时则取代在间位.据此按先后顺序写出以A为原料合成邻氨基苯甲酸(
)易被氧化,苯环上连有烷基时再引入一个取代基,常取代在烷基的邻对位,而当苯环上连有羧基时则取代在间位.据此按先后顺序写出以A为原料合成邻氨基苯甲酸(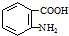 )合成路线中两种中间产物的结构简式(部分反应条件已略去)
)合成路线中两种中间产物的结构简式(部分反应条件已略去)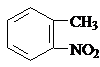 ,
,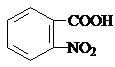 .
.