题目内容
13.在某温度下,可逆反应mA(g)+nB(g)?pC(g)+qD(g)的平衡常数为K,下列说法正确的是( )| A. | K越大,反应达到平衡时所用的时间越短 | |
| B. | K越小,达到平衡时,反应物的 转化率越大 | |
| C. | K随反应物浓度改变而改变 | |
| D. | K越大,达到平衡时,反应进行的程度越大 |
分析 平衡常数K只与温度有关,可表示反应正向进行的程度,与反应速率、浓度等无关,以此来解答.
解答 解:A.K与反应速率无关,则K越大,反应达到平衡的时间不一定越短,故A错误;
B.K越小,达到平衡时,反应物的转化率越小,故B错误;
C.K与浓度无关,不随浓度的改变而改变,故C错误;
D.K越大,达到平衡时,反应进行的程度越大,即K可衡量反应正向进行的趋势,故D正确;
故选D.
点评 本题考查化学平衡常数的含义,为高频考点,把握K只与温度有关及K的意义为解答的关键,侧重分析与应用能力的考查,注意选项A为易错点,题目难度不大.

练习册系列答案
相关题目
3.一氯甲烷(CH3C1)是一种重要的化工原料,常温下它是无色有毒气体,微溶于水,易溶于乙醇、CCl4等.(1)甲组同学在实验室用图1所示装置模拟催化法制备和收集一氯甲烷.
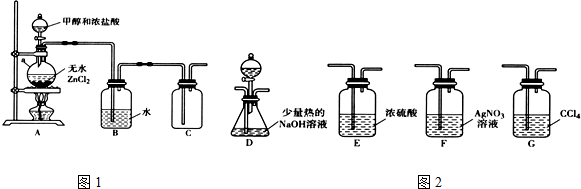
①无水ZnCl2为催化剂,a瓶中发生反应的化学方程式为CH3OH+HCl$→_{△}^{ZnCl_{2}}$CH3Cl+H2O.
②装置B的主要作用是除去氯化氢气体.
③收集到的CH3Cl气体在氧气中充分燃烧,产物用过量的V1mL、c1mol•L-1NaOH溶液充分吸收,以甲基橙作指示剂,用c2 mol•L-1盐酸标准液对吸收液进行返滴定(发生的反应为:
NaOH+HCl=NaCl+H2O,Na2CO3+2HCl=2NaCl+2CO2↑+2H2O),最终消耗V2mL盐酸.则所收集CH3Cl的物质的量为(c1V1-c2V2)×10-3 _ mol.(已知:2CH3Cl+3O2$\stackrel{点燃}{→}$2CO2+2H2O+2HCl)
(2)乙组同学选用甲组A、B装置和图2所示的部分装置检验CH3Cl中的氯元素.
(已知:一卤代烷一般要在加热条件下才能与氢氧化钠溶液反应)
①乙组同学的实验装置中,依次连接的合理顺序为A→B→F→D→G.
②通入一段时间的CH3Cl气体,打开装置D中分液漏斗的活塞,观察实验现象.分液漏斗中盛放的试剂是硝酸和硝酸银溶液.
③能证明CH3Cl中含有氯元素的实验现象是F中无白色沉淀生成,D中有白色沉淀生成.
(3)查阅资料可知:AgNO3的乙醇溶液可以检验CH3X中的卤素原子.相关数据如表:
①CH3X通入AgNO3的乙醇溶液中,除有沉淀生成外,还生成硝酸甲酯,请写出硝酸甲酯的结构简式:CH3ONO2.
③将CH3Cl和CH3Br的混合气体通入AgNO3的乙醇溶液中,先出现淡黄色沉淀.请依据表中数据解释原因C-Br键的键能小,更容易断裂,同时溴化银的溶度积常数更小,溴化银更容易形成沉淀.

①无水ZnCl2为催化剂,a瓶中发生反应的化学方程式为CH3OH+HCl$→_{△}^{ZnCl_{2}}$CH3Cl+H2O.
②装置B的主要作用是除去氯化氢气体.
③收集到的CH3Cl气体在氧气中充分燃烧,产物用过量的V1mL、c1mol•L-1NaOH溶液充分吸收,以甲基橙作指示剂,用c2 mol•L-1盐酸标准液对吸收液进行返滴定(发生的反应为:
NaOH+HCl=NaCl+H2O,Na2CO3+2HCl=2NaCl+2CO2↑+2H2O),最终消耗V2mL盐酸.则所收集CH3Cl的物质的量为(c1V1-c2V2)×10-3 _ mol.(已知:2CH3Cl+3O2$\stackrel{点燃}{→}$2CO2+2H2O+2HCl)
(2)乙组同学选用甲组A、B装置和图2所示的部分装置检验CH3Cl中的氯元素.
(已知:一卤代烷一般要在加热条件下才能与氢氧化钠溶液反应)
①乙组同学的实验装置中,依次连接的合理顺序为A→B→F→D→G.
②通入一段时间的CH3Cl气体,打开装置D中分液漏斗的活塞,观察实验现象.分液漏斗中盛放的试剂是硝酸和硝酸银溶液.
③能证明CH3Cl中含有氯元素的实验现象是F中无白色沉淀生成,D中有白色沉淀生成.
(3)查阅资料可知:AgNO3的乙醇溶液可以检验CH3X中的卤素原子.相关数据如表:
| 化学键 | C-Cl | C-Br |
| 键能(kJ•mol-1) | 330 | 276 |
| 化合物 | AgCl | AgBr |
| Ksp近似值 | 1.8×10-10 | 5×10-13 |
③将CH3Cl和CH3Br的混合气体通入AgNO3的乙醇溶液中,先出现淡黄色沉淀.请依据表中数据解释原因C-Br键的键能小,更容易断裂,同时溴化银的溶度积常数更小,溴化银更容易形成沉淀.
1. 已知:O2(g)+2H2(g)=2H2O(g)△H=-483.6kJ•mol-1
已知:O2(g)+2H2(g)=2H2O(g)△H=-483.6kJ•mol-1
C(s,石墨)+O2(g)=CO2(g)△H=-393.5kJ•mol-1
CO2(g)+C(s,石墨)=2CO(g)△H=+172.5kJ•mol-1
(1)请写出CO与水蒸汽反应的热化学方程式CO(g)+H2O(g)?CO2(g)+H2(g)△H=-41.2kJ•mol-1
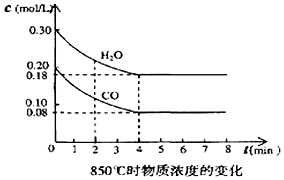
(2)在一体积为10L的密闭容器中,通入一定量的CO和水蒸汽,在850℃时发生反应,容器中CO和水蒸汽浓度变化如图,则0~4min的平均反应速率v(CO)=0.03mol/(L•min),请计算此时的平衡常数K=1.
(3)t℃(高于850℃)时,在相同容器中发生上述反应,容器内各物质的浓度变化如右表.
①表中3min~4min之间反应处于平衡状态;c1数值大于0.08mol/L (填大于、小于或等于).
②反应在4min~5min间,平衡向逆方向移动,可能是以下的原因d(填字母),表中5min~6min之间数值发生变化,可能的原因是a.(填字母)
a.增加水蒸气 b.降低温度 c.使用催化剂 d.增加氢气浓度.
 已知:O2(g)+2H2(g)=2H2O(g)△H=-483.6kJ•mol-1
已知:O2(g)+2H2(g)=2H2O(g)△H=-483.6kJ•mol-1C(s,石墨)+O2(g)=CO2(g)△H=-393.5kJ•mol-1
CO2(g)+C(s,石墨)=2CO(g)△H=+172.5kJ•mol-1
(1)请写出CO与水蒸汽反应的热化学方程式CO(g)+H2O(g)?CO2(g)+H2(g)△H=-41.2kJ•mol-1
(2)在一体积为10L的密闭容器中,通入一定量的CO和水蒸汽,在850℃时发生反应,容器中CO和水蒸汽浓度变化如图,则0~4min的平均反应速率v(CO)=0.03mol/(L•min),请计算此时的平衡常数K=1.
| 时间/min | CO | H2O | CO2 | H2 |
| 0 | 0.200 | 0.300 | 0 | 0 |
| 2 | 0.138 | 0.238 | 0.062 | 0.062 |
| 3 | c1 | c2 | c3 | c3 |
| 4 | c1 | c2 | c3 | c3 |
| 5 | 0.116 | 0.216 | 0.084 | |
| 6 | 0.096 | 0.266 | 0.104 |
①表中3min~4min之间反应处于平衡状态;c1数值大于0.08mol/L (填大于、小于或等于).
②反应在4min~5min间,平衡向逆方向移动,可能是以下的原因d(填字母),表中5min~6min之间数值发生变化,可能的原因是a.(填字母)
a.增加水蒸气 b.降低温度 c.使用催化剂 d.增加氢气浓度.
8.下列离子方程式中正确的是( )
| A. | 用醋酸除去水垢:CaCO3+2H+═Ca2++H2O+CO2↑ | |
| B. | 用小苏打治疗胃酸过多:HCO3-+H+═CO2↑+H2O | |
| C. | 锌片插入硝酸银溶液中:Zn+Ag+═Zn2++Ag | |
| D. | 硫酸溶液与氢氧化铜反应:H++OH-═H2O |
5.反应2Al+Fe2O3$\frac{\underline{\;高温\;}}{\;}$Al2O3+2Fe可用于铁轨的焊接,该反应属于( )
| A. | 化合反应 | B. | 复分解反应 | C. | 置换反应 | D. | 分解反应 |
2.下列叙述错误的是( )
| A. | 任何条件下,等物质的量O2的和CO所含的分子数必相等 | |
| B. | 0.012 kg 12C 含有约6.02×1023个碳原子 | |
| C. | 在使用摩尔表示物质的量的单位时,应用化学式指明粒子的种类 | |
| D. | CH4的摩尔质量为16g |
6.实验室以含有Ca2+、Mg2+、Cl-、SO42-、Br-等离子的卤水为主要原料制备无水CaCl2和Br2,流程如下:

(1)操作Ⅰ使用的试剂是CCl4,所用主要仪器的名称是分液漏斗.
(2)加入溶液W的目的是除去溶液中的SO42-.
用CaO调节溶液Y的pH,可以除去Mg2+.由表中数据可知,理论上可选择pH最大范围是11.0≤pH<12.2.
酸化溶液Z时,使用的试剂为盐酸.
(3)实验室用贝壳与稀盐酸反应制备并收集CO2气体,下列装置中合理的是bd.

(4)工业上由熔融MgCl2制Mg,写出化学方程式MgCl2$\frac{\underline{\;电解\;}}{\;}$Mg+Cl2↑.
(5)化学使生活更美好,下列做法不可行的是AF.
A.用活性炭检验软、硬水 B.用食醋除铁锈
C.用小苏打片治疗胃酸过多 D.用生石灰作食品干燥剂
E.乙烯可以作水果催熟剂 F.福尔马林可以作食品保鲜剂.

(1)操作Ⅰ使用的试剂是CCl4,所用主要仪器的名称是分液漏斗.
(2)加入溶液W的目的是除去溶液中的SO42-.
用CaO调节溶液Y的pH,可以除去Mg2+.由表中数据可知,理论上可选择pH最大范围是11.0≤pH<12.2.
酸化溶液Z时,使用的试剂为盐酸.
| 开始沉淀时的pH | 沉淀完全时的pH | |
| Mg2+ | 9.6 | 11.0 |
| Ca2+ | 12.2 | c(OH-)=1.8mol•L-1 |

(4)工业上由熔融MgCl2制Mg,写出化学方程式MgCl2$\frac{\underline{\;电解\;}}{\;}$Mg+Cl2↑.
(5)化学使生活更美好,下列做法不可行的是AF.
A.用活性炭检验软、硬水 B.用食醋除铁锈
C.用小苏打片治疗胃酸过多 D.用生石灰作食品干燥剂
E.乙烯可以作水果催熟剂 F.福尔马林可以作食品保鲜剂.
 ;
;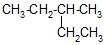 的系统命名为3-甲基戊烷;
的系统命名为3-甲基戊烷; ;
;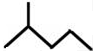 表示的分子式C6H14;名称是2-甲基戊烷.
表示的分子式C6H14;名称是2-甲基戊烷.