题目内容
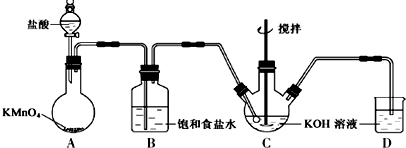
6.实验室以含有Ca2+、Mg2+、Cl-、SO42-、Br-等离子的卤水为主要原料制备无水CaCl2和Br2,流程如下:
(1)操作Ⅰ使用的试剂是CCl4,所用主要仪器的名称是分液漏斗.
(2)加入溶液W的目的是除去溶液中的SO42-.
用CaO调节溶液Y的pH,可以除去Mg2+.由表中数据可知,理论上可选择pH最大范围是11.0≤pH<12.2.
酸化溶液Z时,使用的试剂为盐酸.
| 开始沉淀时的pH | 沉淀完全时的pH | |
| Mg2+ | 9.6 | 11.0 |
| Ca2+ | 12.2 | c(OH-)=1.8mol•L-1 |

(4)工业上由熔融MgCl2制Mg,写出化学方程式MgCl2$\frac{\underline{\;电解\;}}{\;}$Mg+Cl2↑.
(5)化学使生活更美好,下列做法不可行的是AF.
A.用活性炭检验软、硬水 B.用食醋除铁锈
C.用小苏打片治疗胃酸过多 D.用生石灰作食品干燥剂
E.乙烯可以作水果催熟剂 F.福尔马林可以作食品保鲜剂.
分析 实验室以含有Ca2+、Mg2+、Cl-、Br-等离子的卤水为主要原料制备无水CaCl2和Br2,应将混合物中的Mg2+、SO42-、Br-等离子除去,根据流程可以看出分别加入氯气将溶液中的Br-氧化溴单质,加入氯化钡除去SO42-,用CaO调节溶液Y的pH,可以除去Mg2+.
(1)单质溴极易溶于有机溶剂,所以可以采用萃取的方法,萃取的主要仪器是分液漏斗;
(2)分析表中数据可知pH大于11时Mg2+沉淀完全,pH大于12.2时,Ca2+开始沉淀,所以理论上可选择pH最大范围是11.0≤pH<12.2;除杂时不能引入新的杂质;
(3)CO2的密度大于空气中的,所以采用向上排空气发收集CO2气体.若采用长颈漏斗时,长颈漏斗的下端必需插入到溶液中,以防止CO2气体从长颈漏斗中挥发出来;
(4)工业上电解熔融MgCl2得Mg和氯气;
(5)A.用肥皂水检验软、硬水,泡沫多的为软水,泡沫少的为硬水;
B.食醋能与氧化铁反应;
C.小苏打片能与胃酸反应并且碱性很弱;
D.生石灰与水反应;
E.乙烯具有催熟作用;
F.福尔马林有毒;
解答 解:(1)氯气具有强氧化性,通入氯气后可以将溶液中的Br-氧化溴单质,因为单质溴极易溶于有机溶剂,所以可以采用萃取的方法,萃取的主要仪器是分液漏斗.由流程图可知单质溴在下层,因此该有机溶剂的密度要比水的大且不溶于水,所以该试剂是CCl4,故答案为:CCl4;分液漏斗;
(2)由于SO42-会与Ca2+结合形成微溶性的硫酸钙而影响氯化钙的制备,因此必需除去;由表中数据可知pH大于11时Mg2+沉淀完全,pH大于12.2时,Ca2+开始沉淀,所以理论上可选择pH最大范围是11.0≤pH<12.2;因为不能引入新的杂质,所以酸化溶液Z时,使用的试剂应该为盐酸,
故答案为:除去溶液中的SO42-;11.0≤pH<12.2;盐酸;
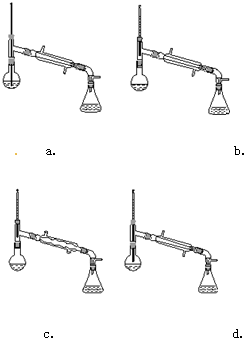
(3)实验室制取CO2的特点是固体和液体反应且不需要加热,由于盐酸易挥发,因此在收集之前需要出去挥发出HCl气体,因为CO2的密度大于空气中的,所以采用向上排空气发收集CO2气体.若采用长颈漏斗时,长颈漏斗的下端必须插入到溶液中,以防止CO2气体从长颈漏斗中挥发出来,因此选项b、d正确,故答案为:bd;
(4)工业上电解熔融MgCl2得Mg和氯气,化学方程式为MgCl2$\frac{\underline{\;电解\;}}{\;}$Mg+Cl2↑,故答案为:MgCl2$\frac{\underline{\;电解\;}}{\;}$Mg+Cl2↑;
(5)A、用肥皂水检验软、硬水,泡沫多的为软水,泡沫少的为硬水,不是用活性炭,故A错误;
B、食醋能与氧化铁反应,所以用食醋除铁锈,故B正确;
C、小苏打片能与胃酸反应并且碱性很弱,所以用小苏打片治疗胃酸过多,故C正确;
D、生石灰与水反应,所以用生石灰作食品干燥剂,故D正确;
E、乙烯具有催熟作用,则乙烯可以作水果的催熟剂,故E正确;
F、福尔马林有毒,不能作为食品保鲜剂,故F错误;
故选:AF.
点评 本题主要考查常见的基本实验操作、仪器的使用和实验方案设计,综合性强,难度大.

| A. | K越大,反应达到平衡时所用的时间越短 | |
| B. | K越小,达到平衡时,反应物的 转化率越大 | |
| C. | K随反应物浓度改变而改变 | |
| D. | K越大,达到平衡时,反应进行的程度越大 |
| A. | 用蘸有浓氨水的棉棒检验输送氯气的管道是否漏气 | |
| B. | 用CO2合成聚碳酸酯可降解塑料,实现“碳”的循环利用 | |
| C. | 大力实施矿物燃料脱硫脱硝技术,能减少二氧化硫、氮氧化物的排放 | |
| D. | 纳米铁粉可以高效地去除被污染水体中的Pb2+、Cu2+、Cd2+、Hg2+等重金属离子,其本质是纳米铁粉对重金属离子较强的物理吸附. |

| 相对分子质量 | 密度/(g•cm-3) | 沸点/℃ | 水中溶解性 | |
| 异戍醇 | 88 | 0.8123 | 131 | 微溶 |
| 乙酸 | 60 | 1.0492 | 118 | 溶 |
| 乙酸异戊酯 | 130 | 0.8670 | 142 | 难溶 |
在A中加入4.4g异戊醇、6.0g乙酸、数滴浓硫酸和2~3片碎瓷片.开始缓慢加热A,回流50min.反应液冷至室温后倒入分液漏斗中,分别用少量水、饱和碳酸氢钠溶液和水洗涤;分出的产物加入少量无水MgSO4固体,静置片刻,过滤除去MgSO4固体,进行蒸馏纯化,收集140~143℃馏分,得乙酸异戊酯3.9g.
回答下列问题:
(1)仪器B的名称是球形冷凝管.
(2)在洗涤操作中,第一次水洗的主要目的是洗掉大部分硫酸和醋酸,第二次水洗的主要目的是洗掉碳酸氢钠.
(3)在洗涤、分液操作中,应充分振荡,然后静置,待分层后d(填标号).
a.直接将乙酸异戊酯从分液漏斗的上口倒出
b.直接将乙酸异戊酯从分液漏斗的下口放出
c.先将水层从分液漏斗的下口放出,再将乙酸异戊酯从下口放出
d.先将水层从分液漏斗的下口放出,再将乙酸异戊酯从上口倒出
(4)本实验中加入过量乙酸的目的是提高醇的转化率.
(5)实验中加入少量无水MgSO4的目的是干燥.
(6)在蒸馏操作中,仪器选择及安装都正确的是b(填标号).
(7)本实验的产率是c(填标号).
a.30% b.40% c.60% d.90%
(8)在进行蒸馏操作时,若从130℃便开始收集馏分,会使实验的产率偏高(填“高”或“低”),其原因是会收集少量未反应的异戊醇.
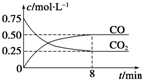 某温度下,在一密闭容器中充入一定量CO2,并加入足量铁粉,发生反应:Fe(s)+CO2(g)?FeO(s)+CO(g),测得CO2和CO浓度随时间的变化如图所示:
某温度下,在一密闭容器中充入一定量CO2,并加入足量铁粉,发生反应:Fe(s)+CO2(g)?FeO(s)+CO(g),测得CO2和CO浓度随时间的变化如图所示:(1)0~8min,v(CO)=0.0625mol•L-1•min-1.
(2)下列措施中,能够改变平衡时c(CO)/c(CO2)的比值的是AD(填序号).
A.温度B.铁粉的量(足量)C.压强D.CO的量
(3)已知:反应Fe(s)+CO2(g)?FeO(s)+CO(g)的平衡常数为K1;
反应Fe(s)+H2O(g)?FeO(s)+H2(g)的平衡常数为K2.不同温度时K1、K2的值如下表:
| 温度/K | K1 | K2 |
| 973 | 1.47 | 2.38 |
| 1173 | 2.15 | 1.67 |
①温度为973K时:K=0.62;
②温度为1173K时:K=1.29;
③反应CO2(g)+H2(g)?CO(g)+H2O(g)是吸热反应(填“吸热”或“放热”).