题目内容
8.下列离子方程式中正确的是( )| A. | 用醋酸除去水垢:CaCO3+2H+═Ca2++H2O+CO2↑ | |
| B. | 用小苏打治疗胃酸过多:HCO3-+H+═CO2↑+H2O | |
| C. | 锌片插入硝酸银溶液中:Zn+Ag+═Zn2++Ag | |
| D. | 硫酸溶液与氢氧化铜反应:H++OH-═H2O |
分析 A.醋酸为弱酸,离子方程式中醋酸不能拆开;
B.小苏打为碳酸氢钠,碳酸氢钠与盐酸反应生成氯化钠、二氧化碳气体和水;
C.离子方程式两边正电荷不相等,违反了电荷守恒;
D.氢氧化铜为难溶物,离子方程式中氢氧化铜不能拆开.
解答 解:A.碳酸钙和醋酸都需要保留化学式,正确的离子方程式为:CaCO3+2CH3COOH=Ca2++H2O+CO2↑+2CH3COO-,故A错误;
B.用小苏打治疗胃酸过多,反应的离子方程式为:HCO3-+H+═CO2↑+H2O,故B正确;
C.锌片插入硝酸银溶液中,二者发生置换反应,正确的离子方程式为:Zn+2Ag+═Zn2++2Ag,故C错误;
D.氢氧化铜不能拆开,正确的离子方程式为:Cu(OH)2+2H+=Cu2++2H2O,故D错误;
故选B.
点评 本题考查了离子方程式的判断,为高考的高频题,属于中等难度的试题,注意明确离子方程式正误判断常用方法:检查反应物、生成物是否正确,检查各物质拆分是否正确,如难溶物、弱电解质等需要保留化学式,检查是否符合守恒关系(如:质量守恒和电荷守恒等)、检查是否符合原化学方程式等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
19.某温度下,向2L恒容密闭容器中充入1.0mol A和1.0mol B,发生反应:A(g)+B(g)?C(g)经过一段时间后达到平衡.反应过程中测定的部分数据见表,下列说法正确的是( )
| t/s | 0 | 5 | 10 | 20 | 30 |
| n(A)/mol | 1.0 | 0.85 | 0.81 | 0.80 | 0.80 |
| A. | 反应在前5 s的平均速率v(A)=0.03 mol•L-1•s-1 | |
| B. | 达到平衡时,B的转化率为80% | |
| C. | 相同温度下,若起始时向容器中充入2.0 mol C,则达到平衡时C的浓度小于0.2 mol•L-1 | |
| D. | 相同温度下,起始时向容器中充入0.20 mol A、0.20 mol B和1.0 mol C,反应达到平衡前v(正)<v(逆) |
16.下列有关的方程式不正确的是( )
| A. | 测0.1 mol/L氨水的pH为11:NH3•H2O?NH4++OH- | |
| B. | 水滴石穿:CO2+CaCO3+H2O═Ca(HCO3)2 | |
| C. | NH4Cl溶解在T2O中:NH4++T2O?NH3•T2O+H+ | |
| D. | 乙烷的燃烧热为-1559.9 kJ•mol-1,则乙烷燃烧的热化学方程式可表示为:2C2H6(g)+7O2(g)═4CO2(g)+6H2O(l)△H=-3119.8kJ•mol-1 |
3.进行化学实验必须注意安全,下列说法不正确的是( )
| A. | 不慎将酸溅到眼中,应立即用水冲洗,边洗边眨眼睛 | |
| B. | 不慎将浓碱沾到皮肤上,应立即用大量水冲洗,然后涂上硼酸溶液 | |
| C. | 稀释浓硫酸时,将浓硫酸沿器壁慢慢注入水中,并不断搅拌 | |
| D. | 实验室中酒精燃烧,小面积着火,立即用水扑灭 |
13.在某温度下,可逆反应mA(g)+nB(g)?pC(g)+qD(g)的平衡常数为K,下列说法正确的是( )
| A. | K越大,反应达到平衡时所用的时间越短 | |
| B. | K越小,达到平衡时,反应物的 转化率越大 | |
| C. | K随反应物浓度改变而改变 | |
| D. | K越大,达到平衡时,反应进行的程度越大 |
20.下列说法正确的是( )
| A. | 28 g氮气含有的原子数为NA | |
| B. | 4g金属钙的物质的量为1mol | |
| C. | 1 mol O2分子的质量等于1 mol氧原子的质量 | |
| D. | 24 g O2分子和24 g O3分子所含的氧原子数目相等 |
17.将112mL乙炔溶于2mol苯中,再加入30g苯乙烯,所得混合物的含碳的质量分数为( )
| A. | 92.3% | B. | 75% | C. | 66.75% | D. | 不能确定 |
1.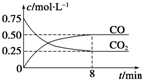 某温度下,在一密闭容器中充入一定量CO2,并加入足量铁粉,发生反应:Fe(s)+CO2(g)?FeO(s)+CO(g),测得CO2和CO浓度随时间的变化如图所示:
某温度下,在一密闭容器中充入一定量CO2,并加入足量铁粉,发生反应:Fe(s)+CO2(g)?FeO(s)+CO(g),测得CO2和CO浓度随时间的变化如图所示:
(1)0~8min,v(CO)=0.0625mol•L-1•min-1.
(2)下列措施中,能够改变平衡时c(CO)/c(CO2)的比值的是AD(填序号).
A.温度B.铁粉的量(足量)C.压强D.CO的量
(3)已知:反应Fe(s)+CO2(g)?FeO(s)+CO(g)的平衡常数为K1;
反应Fe(s)+H2O(g)?FeO(s)+H2(g)的平衡常数为K2.不同温度时K1、K2的值如下表:
根据表中数据,计算反应CO2(g)+H2(g)?CO(g)+H2O(g)的K.
①温度为973K时:K=0.62;
②温度为1173K时:K=1.29;
③反应CO2(g)+H2(g)?CO(g)+H2O(g)是吸热反应(填“吸热”或“放热”).
 某温度下,在一密闭容器中充入一定量CO2,并加入足量铁粉,发生反应:Fe(s)+CO2(g)?FeO(s)+CO(g),测得CO2和CO浓度随时间的变化如图所示:
某温度下,在一密闭容器中充入一定量CO2,并加入足量铁粉,发生反应:Fe(s)+CO2(g)?FeO(s)+CO(g),测得CO2和CO浓度随时间的变化如图所示:(1)0~8min,v(CO)=0.0625mol•L-1•min-1.
(2)下列措施中,能够改变平衡时c(CO)/c(CO2)的比值的是AD(填序号).
A.温度B.铁粉的量(足量)C.压强D.CO的量
(3)已知:反应Fe(s)+CO2(g)?FeO(s)+CO(g)的平衡常数为K1;
反应Fe(s)+H2O(g)?FeO(s)+H2(g)的平衡常数为K2.不同温度时K1、K2的值如下表:
| 温度/K | K1 | K2 |
| 973 | 1.47 | 2.38 |
| 1173 | 2.15 | 1.67 |
①温度为973K时:K=0.62;
②温度为1173K时:K=1.29;
③反应CO2(g)+H2(g)?CO(g)+H2O(g)是吸热反应(填“吸热”或“放热”).