题目内容
19.下列指定反应的离子方程式正确的是( )| A. | 氯气溶于水:Cl2+H2O═2H++Cl-+ClO- | |
| B. | 向CuSO4溶液中加入NaOH:Cu2++2OH-═Cu(OH)2↓ | |
| C. | 在酸性溶液中,KIO3与KI反应生成I2:IO3-+I-+6H+═I2+3H2O | |
| D. | 向Al2(SO4)3溶液中加入过量的NH3?H2O2:Al3++4NH3?H2O2═AlO2-+4NH4++2H2O |
分析 A.次氯酸为弱电解质,应写化学式;
B.铜离子能与氢氧根离子反应生成氢氧化铜蓝色絮状沉淀;
C.方程式左右电荷不守恒;
D.氨水为弱碱,不能溶解氢氧化铝,Al2(SO4)3溶液中加入过量氨水反应生成氢氧化铝和硫酸铵.
解答 解:A.氯气溶于水发生反应:Cl2+H2O?HCl+HClO,离子反应为:Cl2+H2O═H++Cl-+HClO,故A错误;
B.CuSO4溶液中滴加NaOH溶液,铜离子能与氢氧根离子反应生成氢氧化铜蓝色絮状沉淀,离子方程式为:Cu2++2OH-=Cu(OH)2↓,故B正确;
C.酸性溶液中KIO3与KI反应,KI中I元素的化合价由-1价升高为0,KIO3中I元素的化合价由+5价降低为0,生成3molI2,有5molI-被氧化,离子反应为:IO3-+5I-+6H +═3I2+3H2O,故C错误;
D.Al2(SO4)3溶液中加入过量氨水反应生成氢氧化铝和硫酸铵,离子方程式:Al3++3NH3•H2O═Al(OH)3↓+3NH4+,故D错误;
故选B.
点评 本题考查了离子方程式的书写,明确反应实质是解题关键,注意离子方程式应遵循客观事实,遵循原子个数、电荷守恒规律,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
9.某有机物分子式为C4H8,据此推测其结构和性质不可能的是( )
| A. | 它与乙烯可能是同系物 | |
| B. | 一氯代物只有一种 | |
| C. | 分子结构中甲基的数目可能是0、1、2 | |
| D. | 等质量的CH4和C4H8,分别在氧气中完全燃烧,CH4的耗氧量小于C4H8 |
10.在无色强酸性溶液中,下列各组离子能够大量共存的是( )
| A. | K+、Ba2+、Cl-、SO42- | B. | NH4+、HCO3-、Cl-、K+ | ||
| C. | Cl-、Na+、NO3-、Ca2+ | D. | Fe2+、NO3-、I-、Cl- |
7.现有一瓶物质甲和乙的混合物,已知甲和乙的某些性质如表
据此,将甲和乙互相分离的最佳方法是( )
| 物质 | 化学式 | 熔点/℃ | 沸点/℃ | 密度/g.cm-3 | 在水中溶解度 |
| 甲 | C3H6O2 | -98 | 57.5 | 0.93 | 可溶 |
| 乙 | C4H8O2 | -84 | 88 | 0.90 | 可溶 |
| A. | 萃取 | B. | 蒸发 | C. | 蒸馏 | D. | 分液 |
14.在某无色碱性溶液中能大量共存的离子组是( )
| A. | Na+、K+、HCO3- | B. | NH4+、Al3+、SO42- | C. | Na+、AlO2-、NO3- | D. | Cu2+、SO42-、Cl- |
8.下列说法或表示方法正确的是( )
| A. | 等质量的硫蒸气和硫磺分别完全燃烧,二者放出的热量一样多 | |
| B. | 氢气的燃烧热为285.8kJ/mol,则氢气燃烧的热化学方程式为2H2(g)+O2(g)═2H2O(l)△H=-285.8 kJ/mol | |
| C. | 2H2(g)+O2(g)═2H2O(l)△H=-Q1 kJ/mol 2H2(g)+O2(g)═2H2O(g)△H=-Q2 kJ/mol,则Q1>Q2 | |
| D. | 已知中和热为57.3 kJ/mol,若将含0.5molH2SO4的浓溶液与含1molNaOH的溶液混合,放出的热量等于57.3kJ |
9.化学与生活、生产、环境等密切相关,下列叙述正确的是( )
| A. | 涤纶、塑料、光导纤维都是有机高分子材料 | |
| B. | 煤经过气化或液化等物理变化可转化为清洁燃料 | |
| C. | 用电镀厂的废水直接灌溉农田,可提高水的利用率 | |
| D. | 工业燃煤中加入适量生石灰,可减少酸雨的形成 |
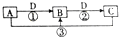 已知A、B、C、D是中学化学的常见物质,且A、B、C均含有同一种元素.在一定条件下,它们之间的相互转化关系如图所示(反应中生成的H2O已略去).请回答下列问题:
已知A、B、C、D是中学化学的常见物质,且A、B、C均含有同一种元素.在一定条件下,它们之间的相互转化关系如图所示(反应中生成的H2O已略去).请回答下列问题: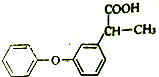 请按要求回答下列问题:
请按要求回答下列问题: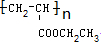 .
.