题目内容
7.现有一瓶物质甲和乙的混合物,已知甲和乙的某些性质如表| 物质 | 化学式 | 熔点/℃ | 沸点/℃ | 密度/g.cm-3 | 在水中溶解度 |
| 甲 | C3H6O2 | -98 | 57.5 | 0.93 | 可溶 |
| 乙 | C4H8O2 | -84 | 88 | 0.90 | 可溶 |
| A. | 萃取 | B. | 蒸发 | C. | 蒸馏 | D. | 分液 |
分析 由表格数据可知,二者互溶,只有沸点不同,以此来解答.
解答 解:由表格数据可知,甲和乙互溶,只有沸点不同,则甲和乙互相分离的最佳方法是蒸馏法,
故选C.
点评 本题考查混合物分离、提纯方法的选择,为高频考点,把握表格数据的分析和应用、混合物的分离原理为解答的关键,侧重分析与应用能力的考查,题目难度不大.

练习册系列答案
 课课练江苏系列答案
课课练江苏系列答案 名牌中学课时作业系列答案
名牌中学课时作业系列答案 明天教育课时特训系列答案
明天教育课时特训系列答案
相关题目
17.下列说法正确的是:( )
| A. | 工业上常使用电解精炼法将粗铜提纯,在电解精练时,阳极减少的质量等于阴极增加的质量 | |
| B. | 心脏起搏器中使用的新型Li-I2 电池的寿命已超过10年,其反应可简单表示为2Li+I2═2LiI,阴极反应为:2Li-2e-═2Li+ | |
| C. | 为了降低某水库的铁闸门被腐蚀的速率,其中焊接在铁闸门上的金属材料可以是锌 | |
| D. | 某物质的溶解度为难溶,则该物质不溶于水. |
18.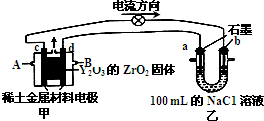 已知:①CH4(g)+H2O(g)═CO(g)+3H2(g)△H=+206.2kJ/mol
已知:①CH4(g)+H2O(g)═CO(g)+3H2(g)△H=+206.2kJ/mol
②CH4(g)+CO2(g)═2CO(g)+2H2(g)△H=-247.4kJ/mol
(1)CH4(g)与H2O(g)反应生成CO2(g)和H2(g)的热化学方程式为CH4(g)+2H2O(g)=CO2(g)+4H2(g)△H=+659.8 kJ/mol
(2)科学家制造出一种使用固体电解质的燃料电池,其效率更高,可用于航空航天.如图所示装置中,以稀土金属材料为惰性电极,在两极上分别通入甲烷和空气,其中固体电解质是掺杂了Y2O3的ZrO2固体,它在高温下能传导O2-.请回答下列问题:
①d电极上的反应式为CH4-8e-+4O2-=CO2+2H2O
②图乙是电解100mL 0.5mol/L的NaC1溶液,若a电极上产生112mL(标准状况)气体,则所得溶液的pH=13(不考虑溶液体积的变化).
(3)将一定量纯净的氨基甲酸铵置于真空密闭容器中(假设容器体积不变,固态试样体积忽略不计),在恒定的温度下使其分解达到平衡:
H2NCOONH4(s)═2NH3(g)+CO2(g).实验测得不同温度下的数据如表:
①氨基甲酸铵分解反应的焓变△H>0(填“>”、“<”或“=”).
②可以判断该分解反应已经达到化学平衡的是BC(填序号).
A.2υ(NH3)=υ(CO2) B.密闭容器中气体总压强不变
C.密闭容器中混合气体的密度不变 D.密闭容器中氨气的体积分数不变
③根据表中数据,计算25℃时氨基甲酸铵的分解平衡常数为1.64×10-8(mol/L)3(保留两位小数).
(4)25℃时,NH3•H2O电离常数K=1.8×10-5,Mg(OH)2的溶度积常数Ksp=1.8×10-11,在某MgC12溶液中加入一定量的某浓度的氨水后,测得混合液pH=11,计算此温度下残留在溶液中的c(Mg2+)=1.8×10-5mol/L.
 已知:①CH4(g)+H2O(g)═CO(g)+3H2(g)△H=+206.2kJ/mol
已知:①CH4(g)+H2O(g)═CO(g)+3H2(g)△H=+206.2kJ/mol②CH4(g)+CO2(g)═2CO(g)+2H2(g)△H=-247.4kJ/mol
(1)CH4(g)与H2O(g)反应生成CO2(g)和H2(g)的热化学方程式为CH4(g)+2H2O(g)=CO2(g)+4H2(g)△H=+659.8 kJ/mol
(2)科学家制造出一种使用固体电解质的燃料电池,其效率更高,可用于航空航天.如图所示装置中,以稀土金属材料为惰性电极,在两极上分别通入甲烷和空气,其中固体电解质是掺杂了Y2O3的ZrO2固体,它在高温下能传导O2-.请回答下列问题:
①d电极上的反应式为CH4-8e-+4O2-=CO2+2H2O
②图乙是电解100mL 0.5mol/L的NaC1溶液,若a电极上产生112mL(标准状况)气体,则所得溶液的pH=13(不考虑溶液体积的变化).
(3)将一定量纯净的氨基甲酸铵置于真空密闭容器中(假设容器体积不变,固态试样体积忽略不计),在恒定的温度下使其分解达到平衡:
H2NCOONH4(s)═2NH3(g)+CO2(g).实验测得不同温度下的数据如表:
| 温度(℃) | 15.0 | 20.0 | 25.0 | 30.0 | 35.0 |
| 平衡气体总浓度(×10-3mol/L) | 2.4 | 3.4 | 4.8 | 6.8 | 9.4 |
②可以判断该分解反应已经达到化学平衡的是BC(填序号).
A.2υ(NH3)=υ(CO2) B.密闭容器中气体总压强不变
C.密闭容器中混合气体的密度不变 D.密闭容器中氨气的体积分数不变
③根据表中数据,计算25℃时氨基甲酸铵的分解平衡常数为1.64×10-8(mol/L)3(保留两位小数).
(4)25℃时,NH3•H2O电离常数K=1.8×10-5,Mg(OH)2的溶度积常数Ksp=1.8×10-11,在某MgC12溶液中加入一定量的某浓度的氨水后,测得混合液pH=11,计算此温度下残留在溶液中的c(Mg2+)=1.8×10-5mol/L.
2.下列实验操作或实验事故处理正确的是( )
| A. | 不慎将浓碱溶液沾到皮肤上,立即用大量硫酸冲洗,然后再用水冲洗 | |
| B. | 不慎将酸溅到眼中,立即用大量水冲洗,边洗边眨眼睛 | |
| C. | 实验时手指上不小心沾上浓硫酸,立即用NaOH溶液清洗 | |
| D. | 酒精不慎洒在实验桌上烧起来时,立即用水浇灭 |
12.硅及其化合物在生产生活中应用广泛,下列说法错误的是( )
| A. | 水泥是建筑工业的基础材料,可用黏土、石灰石等原料来制得 | |
| B. | 常温下,二氧化硅可与NaOH溶液反应 | |
| C. | 向硅酸钠溶液中滴加稀盐酸,溶液中不会出现沉淀 | |
| D. | 晶体硅是良好的半导体材料 |
19.下列指定反应的离子方程式正确的是( )
| A. | 氯气溶于水:Cl2+H2O═2H++Cl-+ClO- | |
| B. | 向CuSO4溶液中加入NaOH:Cu2++2OH-═Cu(OH)2↓ | |
| C. | 在酸性溶液中,KIO3与KI反应生成I2:IO3-+I-+6H+═I2+3H2O | |
| D. | 向Al2(SO4)3溶液中加入过量的NH3?H2O2:Al3++4NH3?H2O2═AlO2-+4NH4++2H2O |
16.将0.2molCO2通入装有足量Na2O2的干燥管中,干燥管增重的质量为( )
| A. | 2.8g | B. | 5.6g | C. | 8.8g | D. | 11.2g |
17.下列物质对水的电离平衡不产生影响的是( )
| A. | H2SO4 | B. | Ba(OH)2 | C. | KCl | D. | CH3COONa |