题目内容
8.下列说法或表示方法正确的是( )| A. | 等质量的硫蒸气和硫磺分别完全燃烧,二者放出的热量一样多 | |
| B. | 氢气的燃烧热为285.8kJ/mol,则氢气燃烧的热化学方程式为2H2(g)+O2(g)═2H2O(l)△H=-285.8 kJ/mol | |
| C. | 2H2(g)+O2(g)═2H2O(l)△H=-Q1 kJ/mol 2H2(g)+O2(g)═2H2O(g)△H=-Q2 kJ/mol,则Q1>Q2 | |
| D. | 已知中和热为57.3 kJ/mol,若将含0.5molH2SO4的浓溶液与含1molNaOH的溶液混合,放出的热量等于57.3kJ |
分析 A.硫蒸气变化为硫固体为放热过程;
B.燃烧热是1mol可燃物完全燃烧生成稳定氧化物放出的热量;
C.H2O(g)→H2O(l)为放热过程;
D.浓硫酸稀释过程中放出热量.
解答 解:A.硫蒸气变化为硫固体为放热过程,则等量的硫蒸气和硫固体在氧气中分别完全燃烧,放出热量硫蒸气多,故A错误;
B.在101kpa时,2gH2完全燃烧,生成液态水,放出285.8KJ热量,则氢气燃烧的热化学方程式表示为:H2(g)+$\frac{1}{2}$O2(g)═H2O(l)△H=-285.8KJ/mol,故B错误;
C.H2O(g)→H2O(l)为放热过程,2molH2(g)和1mol O2(g)反应生成2mol H2O(l)时放出的热量多,即Q1>Q2,故C正确;
D.浓硫酸稀释过程中放出热量,所以放出的热量大于57.3kJ,故D错误;
故选C.
点评 本题考查反应热与焓变,题目难度不大,注意反应热的表示方法,易错点为D,注意浓硫酸溶于水放热的特点.

练习册系列答案
相关题目
18. 已知:①CH4(g)+H2O(g)═CO(g)+3H2(g)△H=+206.2kJ/mol
已知:①CH4(g)+H2O(g)═CO(g)+3H2(g)△H=+206.2kJ/mol
②CH4(g)+CO2(g)═2CO(g)+2H2(g)△H=-247.4kJ/mol
(1)CH4(g)与H2O(g)反应生成CO2(g)和H2(g)的热化学方程式为CH4(g)+2H2O(g)=CO2(g)+4H2(g)△H=+659.8 kJ/mol
(2)科学家制造出一种使用固体电解质的燃料电池,其效率更高,可用于航空航天.如图所示装置中,以稀土金属材料为惰性电极,在两极上分别通入甲烷和空气,其中固体电解质是掺杂了Y2O3的ZrO2固体,它在高温下能传导O2-.请回答下列问题:
①d电极上的反应式为CH4-8e-+4O2-=CO2+2H2O
②图乙是电解100mL 0.5mol/L的NaC1溶液,若a电极上产生112mL(标准状况)气体,则所得溶液的pH=13(不考虑溶液体积的变化).
(3)将一定量纯净的氨基甲酸铵置于真空密闭容器中(假设容器体积不变,固态试样体积忽略不计),在恒定的温度下使其分解达到平衡:
H2NCOONH4(s)═2NH3(g)+CO2(g).实验测得不同温度下的数据如表:
①氨基甲酸铵分解反应的焓变△H>0(填“>”、“<”或“=”).
②可以判断该分解反应已经达到化学平衡的是BC(填序号).
A.2υ(NH3)=υ(CO2) B.密闭容器中气体总压强不变
C.密闭容器中混合气体的密度不变 D.密闭容器中氨气的体积分数不变
③根据表中数据,计算25℃时氨基甲酸铵的分解平衡常数为1.64×10-8(mol/L)3(保留两位小数).
(4)25℃时,NH3•H2O电离常数K=1.8×10-5,Mg(OH)2的溶度积常数Ksp=1.8×10-11,在某MgC12溶液中加入一定量的某浓度的氨水后,测得混合液pH=11,计算此温度下残留在溶液中的c(Mg2+)=1.8×10-5mol/L.
 已知:①CH4(g)+H2O(g)═CO(g)+3H2(g)△H=+206.2kJ/mol
已知:①CH4(g)+H2O(g)═CO(g)+3H2(g)△H=+206.2kJ/mol②CH4(g)+CO2(g)═2CO(g)+2H2(g)△H=-247.4kJ/mol
(1)CH4(g)与H2O(g)反应生成CO2(g)和H2(g)的热化学方程式为CH4(g)+2H2O(g)=CO2(g)+4H2(g)△H=+659.8 kJ/mol
(2)科学家制造出一种使用固体电解质的燃料电池,其效率更高,可用于航空航天.如图所示装置中,以稀土金属材料为惰性电极,在两极上分别通入甲烷和空气,其中固体电解质是掺杂了Y2O3的ZrO2固体,它在高温下能传导O2-.请回答下列问题:
①d电极上的反应式为CH4-8e-+4O2-=CO2+2H2O
②图乙是电解100mL 0.5mol/L的NaC1溶液,若a电极上产生112mL(标准状况)气体,则所得溶液的pH=13(不考虑溶液体积的变化).
(3)将一定量纯净的氨基甲酸铵置于真空密闭容器中(假设容器体积不变,固态试样体积忽略不计),在恒定的温度下使其分解达到平衡:
H2NCOONH4(s)═2NH3(g)+CO2(g).实验测得不同温度下的数据如表:
| 温度(℃) | 15.0 | 20.0 | 25.0 | 30.0 | 35.0 |
| 平衡气体总浓度(×10-3mol/L) | 2.4 | 3.4 | 4.8 | 6.8 | 9.4 |
②可以判断该分解反应已经达到化学平衡的是BC(填序号).
A.2υ(NH3)=υ(CO2) B.密闭容器中气体总压强不变
C.密闭容器中混合气体的密度不变 D.密闭容器中氨气的体积分数不变
③根据表中数据,计算25℃时氨基甲酸铵的分解平衡常数为1.64×10-8(mol/L)3(保留两位小数).
(4)25℃时,NH3•H2O电离常数K=1.8×10-5,Mg(OH)2的溶度积常数Ksp=1.8×10-11,在某MgC12溶液中加入一定量的某浓度的氨水后,测得混合液pH=11,计算此温度下残留在溶液中的c(Mg2+)=1.8×10-5mol/L.
19.下列指定反应的离子方程式正确的是( )
| A. | 氯气溶于水:Cl2+H2O═2H++Cl-+ClO- | |
| B. | 向CuSO4溶液中加入NaOH:Cu2++2OH-═Cu(OH)2↓ | |
| C. | 在酸性溶液中,KIO3与KI反应生成I2:IO3-+I-+6H+═I2+3H2O | |
| D. | 向Al2(SO4)3溶液中加入过量的NH3?H2O2:Al3++4NH3?H2O2═AlO2-+4NH4++2H2O |
16.将0.2molCO2通入装有足量Na2O2的干燥管中,干燥管增重的质量为( )
| A. | 2.8g | B. | 5.6g | C. | 8.8g | D. | 11.2g |
13.如图是温度和压强对反应X+Y?2Z影响的示意图.下列叙述正确的是( )


| A. | 上述可逆反应的正反应为放热反应 | B. | X、Y、Z均为气态 | ||
| C. | X和Y中只有一种是气态,Z为气态 | D. | 上述反应的正反应的△H>0 |
17.下列物质对水的电离平衡不产生影响的是( )
| A. | H2SO4 | B. | Ba(OH)2 | C. | KCl | D. | CH3COONa |
18.下列实验过程中,始终无明显现象的是( )
| A. | SO3通入BaCl2溶液中 | B. | CO2通入CaCl2溶液中 | ||
| C. | NH3通入MgCl2溶液中 | D. | Cl2通入KI淀粉溶液中 |
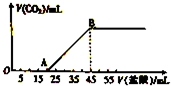 将5.08g由Na2CO3和NaHCO3组成的固体混合物完全溶于水,制成溶液,然后向该溶液中逐滴加入2mol?L-1的盐酸,所加入盐酸的体积与产生CO2体积(标准状况)的关系如图所示.
将5.08g由Na2CO3和NaHCO3组成的固体混合物完全溶于水,制成溶液,然后向该溶液中逐滴加入2mol?L-1的盐酸,所加入盐酸的体积与产生CO2体积(标准状况)的关系如图所示. 某同学组装了如图所示的电化学装置.电极Ⅰ为Al,其他电极均为Cu.
某同学组装了如图所示的电化学装置.电极Ⅰ为Al,其他电极均为Cu.