题目内容
2.过氧化钠是一种淡黄色固体,它能与二氧化碳反应生成氧气,在潜水艇中用作制氧剂,供人类呼吸之用,它与二氧化碳反应的化学方程式为:2Na2O2+2CO2═2Na2CO3+O2.某学生为了验证这一实验,以足量的大理石、足量的盐酸和1.95克过氧化钠样品为原料,制取O2,设计出如下实验装置: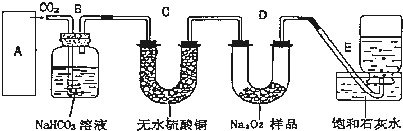
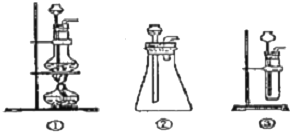
(1)A中制取CO2的装置,应从下列图①、②、③中选哪个图:②、③
B装置的作用是吸收A装置中产生的盐酸酸雾,C装置内可能出现的现象是白色固体变蓝色.为了检验E中收集到的气体,在取出集气瓶后,检验方法是用带火星的木条放在管口,木条复燃说明收集到的气体为氧气.
(2)若E中的石灰水出现出现轻微白色浑浊,请说明原因:Ca2++2OH-+CO2═CaCO3↓+H2O.(用离子反应方程式表示)
(3)反应完毕时,若测得E中的集气瓶收集到的气体为260mL,当装置的气密性良好的情况下,实际收集到的氧气体积比理论计算值小(答大或小),相差20mL(取整数值,所用数据均在标准状况下测定),这是由于Na2O2 没有反应完全或者D装置可能有氧气未被排出.
(4)你认为上述A---E的实验装置中,E部分是否安全、合理?否(答是或否),理由是E装置没有防倒吸装置,容易引起倒吸.
分析 (1)实验室用碳酸钙和稀盐酸反应制备二氧化碳,反应无需加热,采用固液不加热装置制备;实验中要依次进行除杂(除去挥发的HCl)、干燥收集等操作;
(2)E中的石灰水出现出现轻微白色浑浊,说明未反应的二氧化碳和澄清石灰水反应生成碳酸钙白色沉淀;
(3)根据过氧化钠的质量可以生成氧气的体积,理论生成气体的体积-实际氧气的体积=差值,结合反应不完全或者收集不全分析;
(4)根据D中的1.95g过氧化钠样品接近反应完毕时,进入E中的二氧化碳增多,生成氧气减少,是否能产生倒吸现象判断是否合理、安全;
解答 解:(1)该反应的药品是固体和液体,且不需加热,所以所需装置为固液混合不加热型,所以排除①,故选②、③;
大理石和盐酸的反应是放热反应,盐酸具有挥发性,所以制取的二氧化碳中含有氯化氢气体、水蒸气,氯化氢和碳酸氢钠能反应生成二氧化碳,所以B装置的作用是吸收A装置中产生的盐酸酸雾,除去HCl气体;
二氧化碳和无水硫酸铜不反应,水蒸气能使无水硫酸铜由白色变蓝色,所以C装置内可能出现的现象是白色固体变蓝色;
过氧化钠和二氧化碳反应生成氧气,氧气能使带火星的木条复燃,检验时,可用带火星的木条放在管口,木条复燃说明收集到的气体为氧气,
故答案为:②、③;吸收A装置中产生的盐酸酸雾;白色固体变蓝色;用带火星的木条放在管口,木条复燃说明收集到的气体为氧气;
(2)二氧化碳能使澄清的石灰水变浑浊,若E中石灰水出现轻微白色浑浊,说明未反应的二氧化碳与石灰水反应生成碳酸钙白色沉淀,离子方程式为:Ca2++2OH-+CO2═CaCO3↓+H2O;
故答案为:Ca2++2OH-+CO2═CaCO3↓+H2O;
(3)1.95g过氧化钠完全反应生成氧气的体积为v.
2Na2O2+2CO2═2Na2CO3+O2;
2mol 22.4L
$\frac{1.95g}{78g/mol}$=0.025mol V
V=$\frac{0.025×22.4}{2}$L=0.28L=280mL>260mL,所以实际收集到的氧气体积比理论计算值小,280mL-260mL=20mL;
原因是Na2O2 没有反应完全或者D装置可能有氧气未被排出;
故答案为:小;30;Na2O2可能含有不与二氧化碳反应的其它杂质,D装置可能有氧气未被排出;
(4)E装置饱和石灰水能和二氧化碳反应,所以饱和石灰水的作用是吸收二氧化碳,收集较纯净的氧气,当D中的1.95g过氧化钠样品接近反应完毕时,进入E中的二氧化碳增多,生成氧气减少,压强变小,所以E中可能会因二氧化碳与石灰水反应而倒吸,不安全、不合理;
故答案为:否;E装置没有防倒吸装置,容易引起倒吸.
点评 本题以钠的化合物为载体综合考查学生的分析能力和实验能力,为高频考点,注意把握实验的原理和注意事项,结合物质的性质把握实验,难度中等.

(1)NaClO2的化学名称为亚氯酸钠.
(2)在鼓泡反应器中通入含有SO2和NO的烟气,反应温度为323K,NaClO2溶液浓度为5×10-3mol•L-1.反应一段时间后溶液中离子浓度的分析结果如下表.
| 离子 | SO42- | SO32- | NO3- | NO2- | Cl- |
| c/(mol•L-1) | 8.35×10-4 | 6.87×10-6 | 1.5×10-4 | 1.2×10-5 | 3.4×10-3 |
②随着吸收反应的进行,吸收剂溶液的pH逐渐减小(填“增大”“不变”或“减小”).
③由实验结果可知,脱硫反应速率脱硝反应速率大于(填“大于”或“小于”).原因是除了SO2和NO在烟气中的初始浓度不同,还可能是NO溶解度较低或脱硝反应活化能较高.
| A. | Na2O2 Al2(SO4)3 MgCl2 K2CO3 | B. | BaCl2 Na2SO4 (NH4)SO4 KOH | ||
| C. | AgNO3 NaCl KCl CuCl2 | D. | Fe2(SO4)3 K2CO3 KHSO4 NH4Cl |
| A. | c(C2O42-)+c(HC2O4-)+c(OH-)=c(K+)+c(H+) | |
| B. | c(C2O42-)+c(HC2O4-)+c(H2C2O4)=0.2mol/L | |
| C. | c(C2O42-)<c(HC2O4-)<c(H2C2O4) | |
| D. | c(C2O42-)+c(HC2O4-)+c(H2C2O4)<c(K+) |
 二氯化二硫(S2Cl2)是广泛用于橡胶工业的硫化剂,其分子结构如图所示.常温下,S2Cl2是一种橙黄色的液体,遇水易水解,并产生能使品红褪色的气体,化学方程式为2S2Cl2+2H2O═SO2↑+3S↓+4HCl.下列说法中错误的是( )
二氯化二硫(S2Cl2)是广泛用于橡胶工业的硫化剂,其分子结构如图所示.常温下,S2Cl2是一种橙黄色的液体,遇水易水解,并产生能使品红褪色的气体,化学方程式为2S2Cl2+2H2O═SO2↑+3S↓+4HCl.下列说法中错误的是( )| A. | S2Cl2为含有极性键和非极性键的非极性分子 | |
| B. | 反应中SO2是氧化产物,S是还原产物 | |
| C. | S2Cl2的分子构型与H2O2的分子构型相似 | |
| D. | 反应中,生成3molS,转移电子数目为3NA |