题目内容
16.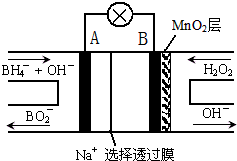 新型NaBH4/H2O2燃料电池(DBFC)的结构如图所示,该电池总反应方程式:NaBH4+4H2O2═NaBO2+6H2O,有关的说法不正确的是( )
新型NaBH4/H2O2燃料电池(DBFC)的结构如图所示,该电池总反应方程式:NaBH4+4H2O2═NaBO2+6H2O,有关的说法不正确的是( )| A. | 电极B为正极,纳米MnO2层的作用是提高原电池的工作效率 | |
| B. | 放电过程中,Na+从正极区向负极区迁移 | |
| C. | 电池负极的电极反应为:BH4-+8OH--8e-═BO2-+6H2O | |
| D. | 在电池反应中,每消耗1L 6mol/L H2O2溶液,理论上流过电路中的电子为12mol |
分析 由工作原理装置图可知,负极发生氧化反应,电极反应式为BH4-+8OH--8e-=BO2-+6H2O,正极H2O2发生还原反应,得到电子被还原生成OH-,电极反应式为H2O2+2e-=2OH-,再结合离子移动方向分析判断.
解答 解:A.电极B材料中包含MnO2层,二氧化锰能促进双氧水分解,所以MnO2可起催化作用,故A正确;
B.原电池工作时,阳离子向正极移动,故B错误;
C.负极发生氧化反应,电极反应式为BH4-+8OH--8e-=BO2-+6H2O,故C正确;
D.在电池反应中,每消耗1L 6mol/L H2O2溶液,理论上流过电路中的电子数为6mol/L×1L×2=12mol,故D正确.
故选B.
点评 本题考查了原电池原理,根据微粒中化合价变化确定正负极,再结合元素化合价变化、离子移动方向等知识点分析解答,难点是电极反应式书写,题目难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
6.根据下列实验事实,得出的结论正确的是( )
| A. | 某气体$\stackrel{通入品红溶液中}{→}$品红溶液褪色 结论:某气体一定是SO2 | |
| B. | 某气体$\stackrel{通入澄清石灰水}{→}$ 产生白色沉淀 结论:某气体一定是CO2 | |
| C. | 某溶液$\stackrel{打开瓶盖}{→}$冒白雾$\stackrel{将沾有浓氨水的玻璃棒靠近}{→}$ 白烟 结论:原溶液一定是浓盐酸 | |
| D. | 某溶液$\stackrel{滴加KSCN溶液液}{→}$ 血红色溶液 结论:原溶液中一定含有Fe3+ |
11.下列离子方程式书写正确的是( )
| A. | 用FeCl3溶液腐蚀铜线路板:Cu+Fe3+═Cu2++Fe2+ | |
| B. | Na2O2与H2O反应产生O2:2Na2O2+2H2O═4Na++4OH-+O2↑ | |
| C. | 将铁溶于稀盐酸:2Fe+6H+═2Fe3++3H2↑ | |
| D. | 向氯化铝溶液中加入过量的氨水:Al3++4NH3•H2O═AlO2-+4NH4++2H2O |
1.使用容器瓶配制溶液时,由于操作不当会引起误差,下列情况会使所配溶液浓度偏高的是( )
| A. | 溶液转移到容量瓶后,烧杯及玻璃棒未用蒸馏水洗涤 | |
| B. | 转移溶液前容量瓶内有少量蒸馏水 | |
| C. | 定容时,俯视容量瓶的刻度线 | |
| D. | 定容摇匀时,发现液面降低,又补加少量水,重新达到刻度线 |
8.在下列化合物中,只有在溶液状态下才能导电的电解质是( )
| A. | NaCl | B. | 酒精 | C. | H2SO4 | D. | Fe |
6.绿矾(FeSO4•7H2O)是治疗缺铁性贫血药品的重要成分.下面是以市售铁屑(含少量锡、氧化铁等杂质)为原料生产纯净绿矾的一种方法:

查询资料,得25℃时有关物质的数据如表:
(1)操作II中,先通入硫化氢至饱和,目的是除去溶液中的Sn2+离子;后加入硫酸酸化至pH=2的作用是防止Fe2+离子生成沉淀.
(2)操作IV得到的绿矾晶体用少量冰水洗涤,其目的是:
①除去晶体表面附着的硫酸等杂质;②降低洗涤过程中FeSO4•7H2O的损耗.
(3)工业上常用氧化还原滴定法测定绿矾产品中Fe2+含量,测定步骤如下:
a.称取2.850g绿矾产品,溶解,在250mL容量瓶中定容;
b.量取25.00mL待测溶液于锥形瓶中;
c.用硫酸酸化的0.01000mol•L-1KMnO4溶液滴定至终点,消耗KMnO4溶液体积的平均值为20.00mL.
①已知酸性KMnO4被FeSO4还原时生成Mn2+.写出该测定过程的离子反应方程式:MnO4-+5Fe2++8H+=Mn2++5Fe3++4H2O;
②滴定时盛放KMnO4溶液的仪器为酸式滴定管(填仪器名称).
③判断此滴定实验达到终点的方法是滴加最后一滴KMnO4溶液时,溶液变成浅红色且半分钟内不褪色.
④若实验操作无失误,测得上述样品中FeSO4•7H2O的含量仍偏低,则可能的原因是:部分Fe2+被空气中O2氧化.

查询资料,得25℃时有关物质的数据如表:
| 饱和H2S溶液 | SnS沉淀完全 | FeS开始沉淀 | FeS沉淀完全 | |
| pH值 | 3.9 | 1.6 | 3.0 | 5.5 |
(2)操作IV得到的绿矾晶体用少量冰水洗涤,其目的是:
①除去晶体表面附着的硫酸等杂质;②降低洗涤过程中FeSO4•7H2O的损耗.
(3)工业上常用氧化还原滴定法测定绿矾产品中Fe2+含量,测定步骤如下:
a.称取2.850g绿矾产品,溶解,在250mL容量瓶中定容;
b.量取25.00mL待测溶液于锥形瓶中;
c.用硫酸酸化的0.01000mol•L-1KMnO4溶液滴定至终点,消耗KMnO4溶液体积的平均值为20.00mL.
①已知酸性KMnO4被FeSO4还原时生成Mn2+.写出该测定过程的离子反应方程式:MnO4-+5Fe2++8H+=Mn2++5Fe3++4H2O;
②滴定时盛放KMnO4溶液的仪器为酸式滴定管(填仪器名称).
③判断此滴定实验达到终点的方法是滴加最后一滴KMnO4溶液时,溶液变成浅红色且半分钟内不褪色.
④若实验操作无失误,测得上述样品中FeSO4•7H2O的含量仍偏低,则可能的原因是:部分Fe2+被空气中O2氧化.
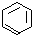 、④HCHO,其中碳原子采取sp2杂化的分子有①③④(填物质编号),HCHO分子的立体构型为平面三角形.
、④HCHO,其中碳原子采取sp2杂化的分子有①③④(填物质编号),HCHO分子的立体构型为平面三角形.