题目内容
3.下列说法正确的是( )| A. | 标准状况下,22.4L水的物质的量为1摩尔 | |
| B. | 常温常压下,32g O3气体物质的量为1摩尔 | |
| C. | 标准状况下,a L的氧气和氮气的混合物含有的分子数约为$\frac{a}{22.4}$×6.02×1023 | |
| D. | 2.24L CO2中含有的原子数为0.3×6.02×1023 |
分析 A.标况下水的状态不是气体;
B.根据n=$\frac{m}{M}$计算臭氧的物质的量;
C.根据n=$\frac{V}{{V}_{m}}$=$\frac{N}{{N}_{A}}$计算;
D.没有告诉在标况下,不能使用标况下的气体摩尔体积计算.
解答 解:A.标准状况下水不是气体,不能使用标况下的气体摩尔体积计算,故A错误;
B.32g O3气体物质的量为:$\frac{32g}{48g/mol}$=$\frac{2}{3}$mol,故B错误;
C.标准状况下,a L的氧气和氮气的混合物的物质的量为:$\frac{aL}{22.4L/mol}$=$\frac{a}{22.4}$mol,含有的分子数约为:$\frac{a}{22.4}$×6.02×1023,故C正确;
D.没有告诉温度和压强,不能使用标况下的气体摩尔体积计算2.24L CO2的物质的量,故D错误;
故选C.
点评 本题考查了物质的量的计算,题目难度不大,明确标况下气体摩尔体积的使用条件为解答关键,注意熟练掌握物质的量与其它物理量之间的关系,试题培养了学生的化学计算能力.

练习册系列答案
相关题目
18.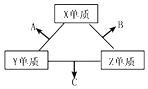 三种元素的常见单质在常温下都是无色气体,在适当条件下可发生如图变化.一个B分子中含有的Z原子个数比C分子中少1个,B、C两种分子中的电子数均等于10.下列判断正确的是( )
三种元素的常见单质在常温下都是无色气体,在适当条件下可发生如图变化.一个B分子中含有的Z原子个数比C分子中少1个,B、C两种分子中的电子数均等于10.下列判断正确的是( )
 三种元素的常见单质在常温下都是无色气体,在适当条件下可发生如图变化.一个B分子中含有的Z原子个数比C分子中少1个,B、C两种分子中的电子数均等于10.下列判断正确的是( )
三种元素的常见单质在常温下都是无色气体,在适当条件下可发生如图变化.一个B分子中含有的Z原子个数比C分子中少1个,B、C两种分子中的电子数均等于10.下列判断正确的是( )| A. | 原子半径:Z<Y<X | B. | 非金属性 Z>Y>X | ||
| C. | 化合物A易溶于水 | D. | 化合物B与C的混合物呈碱性 |
18.将一定体积的稀硝酸平均分成两份,在其中一份中加入足量铜粉,生成的气体在标准状况下的体积为V1;在另一份中先加入与其体积相等的稀硫酸,再加入足量铜粉同,生成的气体在标准状况下的体积为V2,已知V2=3V1.则稀硝酸和稀硫酸的物质的量浓度之比为( )
| A. | 1:1 | B. | 1:2 | C. | 1:3 | D. | 1:4 |
15.下列离子方程式书写正确的是( )
| A. | 碳酸钙与盐酸反应 CO32-+2H+═CO2↑+H2O | |
| B. | 硫酸和氯化钡溶液反应 Ba2++SO42-═BaSO4↓ | |
| C. | 氢氧化钠和少量硫酸反应 2OH-+H2SO4═SO42-+2H2O | |
| D. | 铁钉放入硫酸铜溶液中 Fe+3Cu2+═2Fe3++3Cu |
12.下列事实不能用勒夏特列原理解释的是( )
| A. | 氯水中有下列平衡Cl2+H2O?HCl+HClO,光照后,溶液颜色变浅 | |
| B. | 合成氨反应,为提高氨的产率,理论上应采取较低的温度 | |
| C. | 用饱和食盐水除去Cl2中的HCl | |
| D. | 反应2HI(g)?H2(g)+I2(g),达平衡后,缩小容器体积可使体系颜色变深 |
13.下列有关物质性质的应用的说法正确的是( )
| A. | 金属活泼性铜比铁弱.可在铁船闸上装铜块减缓其腐蚀 | |
| B. | MgO的熔点很高,可用于制作耐高温材科 | |
| C. | 铝能置换出氧化铁中的铁,可用于钢铁工业中大量冶炼铁 | |
| D. | 二氧化硫有漂白、杀菌性能,可在食品生产中大量使用 |