题目内容
14.黄铁矿(主要成分为FeS2,含少量其他金属硫化物)曾是我国一些硫酸厂制取硫酸的主要原料.(1)工业上生产硫酸的第一步是将黄铁矿石粉碎后进行高温煅烧,发生反应的化学方程式为:4FeS2+11O2$\frac{\underline{\;高温\;}}{\;}$ 2Fe2O3+8SO2
①工业上将矿石粉碎后再煅烧,其目的是增大接触面积,加快反应速率.
②将生成的气体通入溴水,溴水褪色,体现了SO2的还原性(选填漂白性、氧化性或还原性)
③当有1molFeS2完全反应时转移的电子数11mol.
(2)某化学兴趣小组称取灼烧后残余固体m克溶于足量稀硫酸,为防止在煅烧后残留固体中仍含有Fe2+,同学们向溶解后溶液中滴入适量酸性高锰酸钾溶液(已知在反应中,MnO4-在酸性条件下可将Fe2+氧化成Fe3+,并被还原为Mn2+),然后用氨水调节溶液的PH值使Fe3+全部转化为氢氧化铁沉淀,过滤、洗涤、灼烧,称重得质量为n克.回答下列问题:
①检验溶解后的溶液中含有Fe3+的方法是取溶解后的溶液少许于试管中,滴入KSCN溶液,若溶液呈红色,则原溶液中含有Fe3+.
②写出在酸性条件下,MnO4-与Fe2+反应的离子方程式MnO4-+5Fe2++8H+=Mn2++5Fe3++4H2O.
③灼烧后残余固体中铁元素的含量是$\frac{7n}{10m}$或$\frac{70n}{m}$%.
(3)在工业生产中,常用铝制或铁制容器贮存浓硫酸,是因为在常温下,铁或铝与浓硫酸发生了钝化现象;硫酸工业生产中排放的尾气中含有的SO2气体是造成硫酸型酸雨的污染物,酸雨是指PH值小于5.6的雨水,硫酸厂上常用氨水(或Na2SO3)来进行尾气处理.
分析 (1)①粉碎的矿石接触面积增大,能增大反应速率,提高反应利用率;
②元素化合价升高的反应物具有还原性,二氧化硫与溴水发生氧化还原反应生成硫酸和氢溴酸,体现了SO2的还原性;
③Fe元素化合价又+2→+3,化合价升高,S元素化合价由-1→+4,化合价升高,O元素化合价由0→-2,化合价降低,根据得失电子守恒分析;
(2)①铁离子的检验方法是:向溶液中加入KSCN溶液,观察现象,若溶液变红色,说明溶液中存在Fe3+,若没有变成红色,证明溶液中没有铁离子;
②Mn元素的化合价由+7价降低为+2价,Fe元素的化合价由+2价升高为+3价,由电子守恒、电荷守恒、原子守恒解答;
③n克为氧化铁的质量,根据铁元素守恒计算;
(3)金属被浓硫酸、浓硝酸氧化,表面生成一层致密的氧化膜,这种氧化膜不溶于浓硫酸、浓硝酸,为金属的钝化;正常的雨水中溶解了二氧化碳,二氧化碳和水反应生成碳酸,碳酸电离导致溶液中氢离子浓度大于氢氧根离子浓度而使溶液呈酸性,正常雨水的pH为5.6,如果雨水溶解了二氧化硫、氮氧化物,会使溶液的酸性更强,PH小于5.6;二氧化硫是酸性氧化物,可用碱性物质氨水来处理;二氧化硫与亚硫酸钠反应生成亚硫酸氢钠,加热亚硫酸氢钠分解得到亚硫酸钠、二氧化硫气体和水,硫酸厂上常用Na2SO3来进行尾气处理.
解答 解:(1)①煅烧时将矿石粉碎的目的是增大接触面积,增大反应速率,提高原料利用率,
故答案为:增大接触面积,加快反应速率;
②二氧化硫与溴水发生氧化还原反应,生成硫酸和HBr,溶液中溴的颜色会褪去,反应的化学方程式为:SO2+Br2+2H2O=H2SO4+2HBr,溴元素从(0→-1)溴单质具有氧化性,硫(+4→+6),化合价升高的反应物具有还原性,二氧化硫具有还原性,
故答案为:还原性;
③FeS2完中Fe元素化合价升高(+2→+3),S元素化合价由-1价升高为+4价,FeS2是还原剂,当有1mol FeS2完全反应时,转移的电子为(3-2)mol+1mol×2×[4-(-1)]=11mol,
故答案为:11mol;
(2)①检验溶液中是否含有Fe3+的方法为:取溶解后的溶液少许于试管中,向溶液中加入KSCN溶液,然后观察现象,若溶液变红色,说明溶液中存在Fe3+,否则没有铁离子,
故答案为:取溶解后的溶液少许于试管中,滴入KSCN溶液,若溶液呈红色,则原溶液中含有Fe3+;
②反应中铁元素从+2价升高为+3价,高锰酸根离子中锰元素从+7价降为+2价,要使得失电子守恒,则二价铁离子系数为5,高锰酸根离子系数为1,离子反应为MnO4-+5Fe2++8H+═Mn2++5Fe3++4H2O,
故答案为:MnO4-+5Fe2++8H+=Mn2++5Fe3++4H2O;
③根据铁元素质量守恒,氧化铁中铁元素的质量等于灼烧后残余固体中铁元素的质量,所以灼烧后残余固体中铁元素的含量是$\frac{\frac{ng}{160g/mol}×2×56g/mol}{mg}$×100%=$\frac{7n}{10m}$=$\frac{70n}{m}$%,
故答案为:$\frac{7n}{10m}$或$\frac{70n}{m}$%;
(3)在常温下,铁或铝与浓硫酸发生钝化,表面生成一层致密的氧化膜,这种氧化膜不溶于浓硫酸,阻止反应进一步进行,正常雨水因溶解了二氧化碳而使其pH为5.6,如果雨水中溶解了二氧化硫或氮氧化物,使雨水变成亚硫酸或硝酸溶液,亚硫酸不稳定易被氧气氧化生成硫酸,硫酸和硝酸都是强酸,导致雨水的pH减小,小于5.6,硫酸工业的尾气中含有二氧化硫,二氧化硫是酸性氧化物,可用碱性物质氨水来处理,将SO2用Na2SO3吸收,再加热所得固体亚硫酸钠、二氧化硫气体和水,该法可循环使用Na2SO3,反应的化学方程式为:Na2SO3+SO2+H2O=2NaHSO3、2NaHSO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2SO3+SO2↑+H2O,
故答案为:钝化,5.6,氨水(或Na2SO3).
点评 本题考查氧化还原反应、离子的检验等知识,侧重氧化还原反应应用、铁、硫的化合物性质的考查,为高频考点,把握反应中元素的化合价变化及守恒法应用为解答的关键,题目难度中等.

 轻巧夺冠周测月考直通中考系列答案
轻巧夺冠周测月考直通中考系列答案| A. | 胆固醇: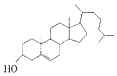 | B. | 芬必得: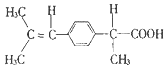 | ||
| C. | 保幼激素JH-I: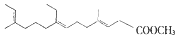 | D. | 维生素C: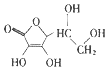 |
 如图是一种新型燃料电池装置示意图,该电池以溶有电解质A的稀盐酸为电解质溶液,它不仅能提供电能,还能起到固氮作用.下列对该电池的说法不正确的是( )
如图是一种新型燃料电池装置示意图,该电池以溶有电解质A的稀盐酸为电解质溶液,它不仅能提供电能,还能起到固氮作用.下列对该电池的说法不正确的是( )| A. | 通入H2的电极为负极,A为NH4Cl | |
| B. | 每转移0.1mol电子,消耗1.12L H2 | |
| C. | 溶液中H+向通入N2的一极移动,Cl-向通入H2的一极移动 | |
| D. | 通入N2的电极发生的电极反应式为N2+6e-+8H+═2NH4+ |
(1)该过程的化学方程式:NaCl+NH3+CO2+H2O=NaHCO3↓+NH4Cl.
(2)加热NaHCO3得到纯碱制品,实验室可进行此操作的装置是BC.

(3)得到的纯碱制品含有少量NaHCO3和NaCl,设计实验验证样品中各种组分.试剂和仪器限选用:试管、胶头滴管、过滤装置、Ba(NO3)2溶液、NaOH溶液、AgNO3溶液、澄清石灰水、稀硫酸、稀盐酸、稀硝酸.
| 步骤一:取少量制品于试管中,加少量蒸馏水,振荡,溶解.往试管中加入过量的Ba(NO3)2溶液振荡,观察 | 现象:溶液中产生大量白色沉淀; 结论:试样中含有Na2CO3. |
| 步骤二:将步骤一的浊液过滤,取滤液于试管中B中,加入适量的NaOH溶液,振荡,观察 | 现象:有少量白色沉淀生成; 结论:样品中含有NaHCO3. |
| 步骤三:将步骤二的浊液过滤,取滤液于试管C中,先加入足量的稀硝酸,再加入少许AgNO3溶液振荡,观察 | 现象:有少量白色沉淀生成; 结论:试样中含有NaCl. |
A.取a克混合物充分加热,减重b克
B.取a克混合物与足量稀盐酸充分反应,加热、蒸干、灼烧,得b克固体
C.取a克混合物与足量稀硫酸充分反应,逸出气体用碱石灰吸收,增重b克
D.取a克混合物与足量Ba(OH)2溶液充分反应,过滤、洗涤、烘干,得b克固体.
若按A方案进行实验,则原混合物中NaHCO3的质量分数为$\frac{a-\frac{84b}{31}}{a}$(用含a、b的代数式表示)
(1)常温下,将pH=3的盐酸a L分别与下列三种溶液混合,结果溶液均呈中性.①浓度为1.0×10-3 mol•L-1的氨水b L;②c(OH-)=1.0×10-3 mol•L-1的氨水c L;③c(OH-)=1.0×10-3 mol•L-1的氢氧化钡溶液d L.
则a、b、c、d之间的关系是b>a=d>c.
(2)已知:Ksp(AgCl)=1.8×10-10,向50mL 0.018mol•L-1的AgNO3溶液中加入相同体积0.020mol•L-1的盐酸,则①c(Ag+)=1.8×10-7mol/L,②此时所得混合溶液的pH=2.
(3)常温下,浓度均为0.1mol•L-1的下列六种溶液的pH如表:
| 溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN | NaX |
| pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 | 11.3 |
②根据表中数据,浓度均为0.01mol•L-1的下列五种物质的溶液中,分别稀释100倍,pH变化最小的是C(填编号).
A、HCN B、HClO C、HX D、CH3COOH E、H2CO3
③据上表数据,请你判断下列反应不能成立的是BD(填编号).
A.2CH3COOH+Na2CO3═CO2+H2O+2CH3COONa
B.HClO+HCO3-═ClO-+CO2+H2O
C.CH3COOH+NaCN═CH3COONa+HCN
D.CO2+H2O+2NaX═Na2CO3+2HX
(4)将NaHCO3溶液与FeCl3溶液混合,反应的离子方程式是:Fe3++3HCO3-=Fe(OH)3↓+3CO2↑.
| A. | 铜既可以发生析氢腐蚀也可以发生吸氧腐蚀 | |
| B. | 铁只能发生析氢腐蚀 | |
| C. | 铜只能发生吸氧腐蚀 | |
| D. | 析氢腐蚀比吸氧腐蚀普遍 |
①SeO2+4KI+4HNO3=Se+2I2+4KNO3+2H2O;
②Se+2H2SO4(浓)=2SO2↑+SeO2+2H2O
下列有关叙述正确的是( )
| A. | SeO2、H2SO4(浓)、I2的氧化性由强到弱的顺序是H2SO4(浓)>SeO2>I2 | |
| B. | ①中Se是氧化产物,I2是还原产物 | |
| C. | 反应①中KI是氧化剂,SeO2是还原剂 | |
| D. | 反应①中每有1.0mol I2生成,转移电子数目为4NA |
| A. | 标准状况下,22.4L水的物质的量为1摩尔 | |
| B. | 常温常压下,32g O3气体物质的量为1摩尔 | |
| C. | 标准状况下,a L的氧气和氮气的混合物含有的分子数约为$\frac{a}{22.4}$×6.02×1023 | |
| D. | 2.24L CO2中含有的原子数为0.3×6.02×1023 |