题目内容
18.将一定体积的稀硝酸平均分成两份,在其中一份中加入足量铜粉,生成的气体在标准状况下的体积为V1;在另一份中先加入与其体积相等的稀硫酸,再加入足量铜粉同,生成的气体在标准状况下的体积为V2,已知V2=3V1.则稀硝酸和稀硫酸的物质的量浓度之比为( )| A. | 1:1 | B. | 1:2 | C. | 1:3 | D. | 1:4 |
分析 铜与稀硝酸反应生成硝酸铜一氧化氮和水;先加入与其等体积的稀硫酸,再投入足量的铜粉反应,溶解的铜比第一份要多,因为硫酸提供氢离子和溶液中的硝酸根离子形成硝酸会继续溶解铜,所以分析反应实质,只需根据发生反应的离子方程式继续计算即可:3Cu+8H++2NO3-=3Cu2++2NO↑+H2O.
解答 解:第一份只有HNO3,发生反应:3Cu+8H++2NO3-=3Cu2++2NO↑+H2O,H+不足,溶液中剩余NO3-,设有8molHNO3,
则生成2molNO,消耗8molH+;
另一份先加入与其等体积的稀硫酸,溶液中硫酸提供H+,3V1=V2,则应生成6molNO,根据3Cu+8H++2NO3-=3Cu2++2NO↑+H2O,可知消耗24molH+,原来硝酸溶液中含溶质8mol,硫酸溶液中含氢离子为16mol,硫酸的物质的量为8mol,硝酸和硫酸是等体积混合,稀硝酸与稀硫酸的物质的量浓度之比为1:1;
故选:A.
点评 本题考查了物质的量浓度有个计算,明确硝酸与铜反应的离子方程式是解题关键,注意计算时应依据离子方程式计算,题目难度中等.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
13.下列有关物质的性质或应用的说法正确的是( )
| A. | 在甲苯中加入少量酸性高锰酸钾溶液,振荡后褪色,正确的解释是由于侧链与苯环的相互影响,使侧链和苯环均易被氧化 | |
| B. | 用核磁共振氢谱鉴别1-丙醇和2-丙醇 | |
| C. | 间二溴苯仅有一种空间结构可证明苯分子中不存在单双键交替的结构 | |
| D. | 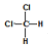 和 和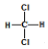 、 、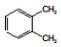 和 和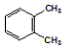 属于同分异构体 属于同分异构体 |
9.水溶液是中学化学的重点研究对象.
(1)常温下,将pH=3的盐酸a L分别与下列三种溶液混合,结果溶液均呈中性.①浓度为1.0×10-3 mol•L-1的氨水b L;②c(OH-)=1.0×10-3 mol•L-1的氨水c L;③c(OH-)=1.0×10-3 mol•L-1的氢氧化钡溶液d L.
则a、b、c、d之间的关系是b>a=d>c.
(2)已知:Ksp(AgCl)=1.8×10-10,向50mL 0.018mol•L-1的AgNO3溶液中加入相同体积0.020mol•L-1的盐酸,则①c(Ag+)=1.8×10-7mol/L,②此时所得混合溶液的pH=2.
(3)常温下,浓度均为0.1mol•L-1的下列六种溶液的pH如表:
①上述盐溶液中的阴离子,结合质子能力最强的是CO32-.
②根据表中数据,浓度均为0.01mol•L-1的下列五种物质的溶液中,分别稀释100倍,pH变化最小的是C(填编号).
A、HCN B、HClO C、HX D、CH3COOH E、H2CO3
③据上表数据,请你判断下列反应不能成立的是BD(填编号).
A.2CH3COOH+Na2CO3═CO2+H2O+2CH3COONa
B.HClO+HCO3-═ClO-+CO2+H2O
C.CH3COOH+NaCN═CH3COONa+HCN
D.CO2+H2O+2NaX═Na2CO3+2HX
(4)将NaHCO3溶液与FeCl3溶液混合,反应的离子方程式是:Fe3++3HCO3-=Fe(OH)3↓+3CO2↑.
(1)常温下,将pH=3的盐酸a L分别与下列三种溶液混合,结果溶液均呈中性.①浓度为1.0×10-3 mol•L-1的氨水b L;②c(OH-)=1.0×10-3 mol•L-1的氨水c L;③c(OH-)=1.0×10-3 mol•L-1的氢氧化钡溶液d L.
则a、b、c、d之间的关系是b>a=d>c.
(2)已知:Ksp(AgCl)=1.8×10-10,向50mL 0.018mol•L-1的AgNO3溶液中加入相同体积0.020mol•L-1的盐酸,则①c(Ag+)=1.8×10-7mol/L,②此时所得混合溶液的pH=2.
(3)常温下,浓度均为0.1mol•L-1的下列六种溶液的pH如表:
| 溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN | NaX |
| pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 | 11.3 |
②根据表中数据,浓度均为0.01mol•L-1的下列五种物质的溶液中,分别稀释100倍,pH变化最小的是C(填编号).
A、HCN B、HClO C、HX D、CH3COOH E、H2CO3
③据上表数据,请你判断下列反应不能成立的是BD(填编号).
A.2CH3COOH+Na2CO3═CO2+H2O+2CH3COONa
B.HClO+HCO3-═ClO-+CO2+H2O
C.CH3COOH+NaCN═CH3COONa+HCN
D.CO2+H2O+2NaX═Na2CO3+2HX
(4)将NaHCO3溶液与FeCl3溶液混合,反应的离子方程式是:Fe3++3HCO3-=Fe(OH)3↓+3CO2↑.
6.二氧化硒(SeO2)是一种氧化剂,其被还原后的单质硒可能成为环境污染物,通过与浓HNO3、浓H2SO4反应生成SeO2以回收Se.在回收过程当中涉及到如下两个化学反应
①SeO2+4KI+4HNO3=Se+2I2+4KNO3+2H2O;
②Se+2H2SO4(浓)=2SO2↑+SeO2+2H2O
下列有关叙述正确的是( )
①SeO2+4KI+4HNO3=Se+2I2+4KNO3+2H2O;
②Se+2H2SO4(浓)=2SO2↑+SeO2+2H2O
下列有关叙述正确的是( )
| A. | SeO2、H2SO4(浓)、I2的氧化性由强到弱的顺序是H2SO4(浓)>SeO2>I2 | |
| B. | ①中Se是氧化产物,I2是还原产物 | |
| C. | 反应①中KI是氧化剂,SeO2是还原剂 | |
| D. | 反应①中每有1.0mol I2生成,转移电子数目为4NA |
13.甲、乙两种物质的溶解曲线如图所示.下列说法正确的是( )
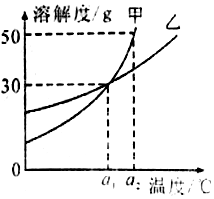

| A. | a1℃时甲和乙的饱和溶液,升温到a2℃时仍是饱和溶液 | |
| B. | 甲和乙的溶解度相等 | |
| C. | a1℃时,甲和乙各30g分别加入100g的水中,均形成饱和溶液 | |
| D. | a2℃时,在100g水中加入60g甲,形成不饱和溶液 |
3.下列说法正确的是( )
| A. | 标准状况下,22.4L水的物质的量为1摩尔 | |
| B. | 常温常压下,32g O3气体物质的量为1摩尔 | |
| C. | 标准状况下,a L的氧气和氮气的混合物含有的分子数约为$\frac{a}{22.4}$×6.02×1023 | |
| D. | 2.24L CO2中含有的原子数为0.3×6.02×1023 |
10.设NA为阿伏伽德罗常数的值.下列说法正确的是( )
| A. | 22.4 L乙烷分子中的碳原子数目为2NA | |
| B. | 高温下,0.2 mol Fe与足量水蒸气反应,生成的H2分子数目为0.3 NA | |
| C. | 含NA个Na+的Na2O溶解于1 L水中,Na+的物质的量浓度为1 mol/L | |
| D. | 5NH4NO3$\frac{\underline{\;\;△\;\;}}{\;}$2HNO3+4N2↑+9H2O反应中,生成28 g N2时,转移的电子数目为3.75NA |
8.一定温度下,在3个体积均为1.0L的恒容密闭容器中发生反应2SO2(g)+O2(g)?2SO3(g)△H<0达到平衡.下列说法正确的是( )
| 容器 | 温度/℃ | 物质的起始浓度/mol•L-1 | 物质的平衡浓度/mol•L-1 | ||
| c(SO2) | c(O2) | c(SO3) | c(SO3) | ||
| Ⅰ | 758 | 0.2 | 0.1 | 0 | 0.044 |
| Ⅱ | 758 | 0.1 | 0.05 | 0 | |
| Ⅲ | 858 | 0.2 | 0.1 | 0 | |
| A. | 从开始至平衡时,容器Ⅰ中SO3的反应速率为0.044 mol•L-1•s-1 | |
| B. | 平衡时,容器Ⅱ中SO3的浓度小于0.022 mol•L-1 | |
| C. | 平衡时,容器Ⅲ中SO3的浓度大于0.044 mol•L-1 | |
| D. | 若起始时,向容器Ⅰ中充入0.02 mol SO2,0.01 mol O2和0.02 mol SO3,则反应向逆反应方向进行 |