题目内容
15.关于胶体和溶液的叙述中正确的是( )| A. | 氢氧化铁胶体带正电 | |
| B. | 胶体加入电解质可产生沉淀,而溶液不能 | |
| C. | 由于胶体是一种介稳性的分散系,因此不易聚沉 | |
| D. | 胶体能够发生丁达尔现象,而溶液则不能 |
分析 A、从胶体分散系呈电中性分析;
B、根据胶体聚沉的条件和复分解的条件分析;
C、胶体较稳定,溶液稳定;
D、丁达尔效应是胶体特有的性质.
解答 解:A、溶液呈电中性,胶体分散系不带电,是胶体粒子吸附带电离子,氢氧化铁胶体不带电,故A错误;
B、胶体加入电解质溶液会发生聚沉可产生沉淀,复分解发生的条件之一是生成沉淀,所以溶液可以生成沉淀,溶液氢氧化钡与硫酸钠反应生成硫酸钡沉淀,故B错误;
C、胶体较稳定,是一种介稳性的分散系,一定条件下容易发生聚沉,故C错误;
D、丁达尔效应是胶体特有的性质,溶液没有丁达尔效应,故D正确,
故选D.
点评 本题考查了胶体和溶液中分散质的组成和性质,题目较简单,注意分析胶粒带电的原因和溶液中溶质的类别.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
5.化学与社会、生产、生活密切相关.下列说法正确的是( )
| A. | 明矾、漂白粉、臭氧的净水原理相同 | |
| B. | 用鸡蛋壳膜和蒸馏水除去淀粉胶体中的食盐不涉及化学变化 | |
| C. | 煤的干馏和石油的分馏都属于物理变化 | |
| D. | 亚硝酸钠是一种食品防腐剂,使用时其用量可以不加限制 |
6.下列离子方程式正确的是( )
| A. | NaHSO4溶液与Ba(OH)2溶液反应至中性:H++SO42-+Ba2++OH-═BaSO4↓+H2O | |
| B. | Mg(OH)2与H2SO4反应:Mg2++2OH-+2H++SO42-═MgSO4↓+2H2O | |
| C. | 镁与醋酸反应 Mg+2H+═Mg2++H2↑ | |
| D. | Na2SO3溶液使酸性KMnO4溶液褪色:5SO32-+6H++2MnO4-═5SO42-+2Mn2++3H2O |
10.分子式为C7H6Cl2的芳香族化合物共有(不含立体异构体)( )
| A. | 6种 | B. | 9种 | C. | 10 种 | D. | 12 种 |
20. 生产上用过量烧碱溶液处理某矿物(含Al2O3、MgO),过滤后得到滤液用NaHCO3溶液处理,测得溶液pH和Al(OH)3生成的量随加入NaHCO3溶液体积变化的曲线如下:下列有关说法不正确的是( )
生产上用过量烧碱溶液处理某矿物(含Al2O3、MgO),过滤后得到滤液用NaHCO3溶液处理,测得溶液pH和Al(OH)3生成的量随加入NaHCO3溶液体积变化的曲线如下:下列有关说法不正确的是( )
 生产上用过量烧碱溶液处理某矿物(含Al2O3、MgO),过滤后得到滤液用NaHCO3溶液处理,测得溶液pH和Al(OH)3生成的量随加入NaHCO3溶液体积变化的曲线如下:下列有关说法不正确的是( )
生产上用过量烧碱溶液处理某矿物(含Al2O3、MgO),过滤后得到滤液用NaHCO3溶液处理,测得溶液pH和Al(OH)3生成的量随加入NaHCO3溶液体积变化的曲线如下:下列有关说法不正确的是( )| A. | NaHCO3溶液的物质的量浓度为0.8 mol/L | |
| B. | b点与c点溶液所含微粒种类相同 | |
| C. | a点溶液中存在的离子是Na+、AlO2-、OH-、H+ | |
| D. | 生成沉淀的离子方程式为:HCO3-+AlO2-+H2O═Al(OH)3↓+CO32- |
7.SO2虽是大气污染物之一,但也是重要的工业原料,某同学在实验室设计如下实验,对SO2的部分性质进行了探究.
(1)二氧化硫的水溶液
①SO2易溶于水,常温常压下溶解度为1:40,其中有H2SO3生成.向SO2的饱和溶液中加入NaHSO3固体,有气体冒出,原因是SO2的水溶液中存在如下平衡SO2+H2O?H2SO3?H++HSO3-加入NaHSO3固体增加了c( HSO3-),平衡左移,降低了SO2的溶解度.(结合有关平衡方程式简要说明)
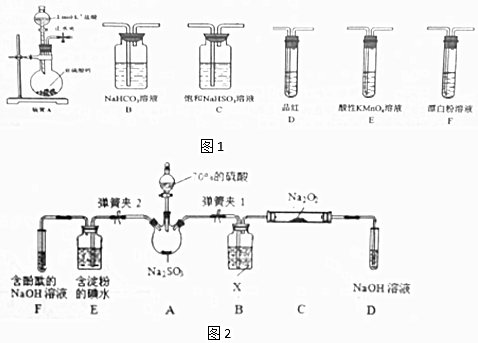
②欲验证酸性:H2SO3>HClO,选用图1的装置,其连接顺序为:A→C→B→E→D→F (按气流方向用大写字母表示即可).能证明H2SO3的酸性强于HClO的实验现象为D中品红不褪色,F中产生白色沉淀.
(2)二氧化硫的还原性
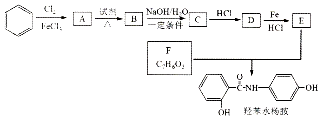
已知SO2具有还原性,可以还原I2,可以与Na2O2发生反应,按图2示装置进行实验.(部分固定装置未画出)
(1)二氧化硫的水溶液
①SO2易溶于水,常温常压下溶解度为1:40,其中有H2SO3生成.向SO2的饱和溶液中加入NaHSO3固体,有气体冒出,原因是SO2的水溶液中存在如下平衡SO2+H2O?H2SO3?H++HSO3-加入NaHSO3固体增加了c( HSO3-),平衡左移,降低了SO2的溶解度.(结合有关平衡方程式简要说明)
②欲验证酸性:H2SO3>HClO,选用图1的装置,其连接顺序为:A→C→B→E→D→F (按气流方向用大写字母表示即可).能证明H2SO3的酸性强于HClO的实验现象为D中品红不褪色,F中产生白色沉淀.

(2)二氧化硫的还原性
已知SO2具有还原性,可以还原I2,可以与Na2O2发生反应,按图2示装置进行实验.(部分固定装置未画出)
| 操作步骤 | 实验现象 | 解释原因 |
| 关闭弹簧夹2,打开弹簧夹1,注入硫酸至浸没三颈烧瓶中固体 | 若将带火星的木条放在D试管口处,木条不复燃 | SO2与Na2O2反应无O2生成,可能发生的化学反应方程式为①Na2O2+SO2=Na2SO4 |
| 若将带火星的木条放在D试管口处,木条复燃 | SO2与Na2O2反应有O2生成,发生的化学反应为:2SO2+2Na2O2═2Na2SO3+O2 | |
| 关闭弹簧夹1,打开弹簧夹2,残余气体进入E,F中. | E中②E 中溶液蓝色褪去 | E中反应的离子方程式③SO2+I2+2H2O=2I-+SO42-+4H+ |
| F中④F 中红色变浅或褪色 | F中反应为2OH-+SO2═SO32-+H2O |
7.NA表示阿伏伽德罗常数,下列说法中正确的是( )
| A. | 标况下,22.4升的H2O含有的水分子数为NA | |
| B. | 标况下,11.2升CCl4中含有的Cl原子数为2NA | |
| C. | 17克NH3中含有的电子总数为10NA | |
| D. | 0.5mol/L的H2SO4溶液中含有的H+数为NA |
 $→_{HCl}^{Fe}$
$→_{HCl}^{Fe}$
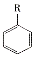 (R-烷基)$\stackrel{KMnO_{4}/H+}{→}$
(R-烷基)$\stackrel{KMnO_{4}/H+}{→}$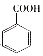
 +2NaOH$→_{△}^{H_{2}O}$
+2NaOH$→_{△}^{H_{2}O}$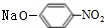 +NaCl+H2O.
+NaCl+H2O. .
.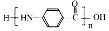 的合成路线
的合成路线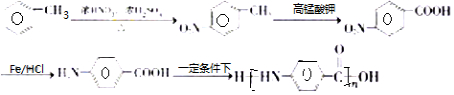 .
. 在含有弱电解质的溶液中,往往有多个化学平衡共存.
在含有弱电解质的溶液中,往往有多个化学平衡共存.