题目内容
8. 在含有弱电解质的溶液中,往往有多个化学平衡共存.
在含有弱电解质的溶液中,往往有多个化学平衡共存.(1)一定温度下,向1L 0.l mol/L-1 CH3 COOH溶液中加入0.1molCH3COONa固体,溶液中$\frac{c(C{H}_{3}CO{O}^{-})•c({H}^{+})}{c(C{H}_{3}COOH)}$不变(填“增大”、“减小”或“不变”);写出表示该混合溶液中所有离子浓度之间的一个等式c(CH3COO-)+c(OH-)=c(H+)+c(Na+).
(2)土壤的pH一般在4-9之间.土壤中Na2CO3含量较高,pH可以高达10.5,试用离子方程式解释土壤呈碱性的原因,加入石膏(CaSO4•2H2O)可以使土壤碱性降低,有关反应的化学方程式为Na2CO3+CaSO4•2H2O=CaCO3↓+Na2SO4+2H2O
(3)常温下在20ml 0.1mo l•L-1 Na2CO3溶液中逐滴加入0.1mol•L-1 HC1溶液40mL,溶液中含碳元素的各种微粒(CO2)因逸出未画出)物质的量分数随溶液pH变化的情况如图所示.
回答下列问题:
①在同一溶液中,H2CO3、HCO3-、CO32-不能(填“能”或“不能”)大量共存;
②当pH=7时,溶液中含碳元素的主要微粒为HCO3-、H2CO3,溶液中各种离子的物质的量浓度的大小关系
为c(Na+)>c(Cl-)>c(HCO3-)>c(OH-)=c(H+);
③已知在25℃时,CO32-水解反应的平衡常数即水解常数Kh=2×10-4mol•L-1,当溶液中c(HCO3-):c(CO32-)=2:1时,溶液的pH=10.
分析 (1)根据稀释后溶液中存在的电离平衡的移动来回答,溶液中存在电荷守恒;
(2)Na2CO3为强碱弱酸盐,水解显碱性;加入石膏(CaSO4•2H2O)可以使土壤碱性降低是钙离子结合碳酸根离子生成碳酸钙沉淀水解平衡逆向进行;
(3)常温下在20mL0.1mol/L Na2CO3溶液中逐滴加入0.1mol/L HCl溶液40mL,先反应生成碳酸氢钠,再与盐酸反应生成二氧化碳、水,
①根据图2可知,pH=8时只有碳酸氢根离子,pH大于8时存在碳酸根离子和碳酸氢根离子离子,pH小于8时存在碳酸和碳酸氢根离子,在同一溶液中,H2CO3、HCO3-、CO32-不能共存;
②pH=7时,溶液中溶质为碳酸氢钠、氯化钠及碳酸,存在的离子主要为:H2CO3、HCO3-,溶液显示中性,c(H+)=c(OH-),根据电荷守恒判断溶液中各离子浓度大小关系;
③根据水解常数计算c(OH-),由根据水的离子积Kw计算c(H+),根据pH=-lgc(H+)计算.
解答 解:(1)向1L 0.1mol•L-1CH3COOH溶液中加入0.1mol CH3COONa固体,则溶液中醋酸浓度,醋酸根离子浓度均增大,比值$\frac{c(C{H}_{3}CO{O}^{-})c({H}^{+})}{c(C{H}_{3}COOH)}$为醋酸的电离平衡常数,平衡常数只随温度变化,不随浓度变化,比值不变,此时溶液中存在电荷守恒:c(CH3COO-)+c(OH-)=c(H+)+c(Na+),
故答案为:不变;c(CH3COO-)+c(OH-)=c(H+)+c(Na+);
(2)土壤的pH一般在4-9之间.土壤中Na2CO3含量较高,pH可以高达10.5,用离子方程式解释土壤呈碱性的原因是:CO32-+H2O?HCO3-+OH-,加入石膏(CaSO4•2H2O)可以使土壤碱性降低,有关反应的化学方程式为:Na2CO3+CaSO4•2H2O=CaCO3↓+Na2SO4+2H2O,
故答案为:CO32-+H2O?HCO3-+OH-;Na2CO3+CaSO4•2H2O=CaCO3↓+Na2SO4+2H2O;
(3)常温下在20mL0.1mol/L Na2CO3溶液中逐滴加入0.1mol/L HCl溶液40mL,先反应生成碳酸氢钠,再与盐酸反应生成二氧化碳、水,
①由反应及图象可知,在同一溶液中,H2CO3、HCO3-、CO32-不能大量共存,
故答案为:不能;
②由图象可知,pH=7时,c(OH-)=c(H+),溶液中含碳元素的主要微粒为HCO3-、H2CO3,电荷守恒可知c(Na+)+c(H+)=c(Cl-)+c(HCO3-)+c(OH-),则c(Na+)>c(Cl-),因HCO3-水解,则c(Na+)>c(Cl-)>c(HCO3-)>c(OH-)=c(H+),
故答案为:HCO3-、H2CO3;c(Na+)>c(Cl-)>c(HCO3-)>c(OH-)=c(H+);
③CO32-的水解常数Kh=$\frac{c(HC{{O}_{3}}^{-})c(O{H}^{-})}{c(C{{O}_{3}}^{2-})}$=2×10-4,当溶液中c(HCO3-):c(CO32-)=2:1时,c(OH-)=10-4mol/L,由Kw可知,c(H+)=10-10mol/L,所以pH=10,故答案为:10.
点评 本题考查较综合,涉及盐类的水解、弱电解质的电离及溶液中酸碱之间的反应,题目难度中等,综合考查学生分析问题、解决问题的能力,注重能力的考查.

 互动英语系列答案
互动英语系列答案| A. | 氢氧化铁胶体带正电 | |
| B. | 胶体加入电解质可产生沉淀,而溶液不能 | |
| C. | 由于胶体是一种介稳性的分散系,因此不易聚沉 | |
| D. | 胶体能够发生丁达尔现象,而溶液则不能 |
①H2S(g)+$\frac{3}{2}$O2(g)═SO2(g)+H2O(g)△H1②2H2S(g)+SO2(g)═$\frac{3}{2}$S2(g)+2H2O(g)△H2
③H2S (g)+$\frac{1}{2}$O2(g)═S(g)+H2O(g)△H3④2S(g)═S2(g)△H4
则△H4的正确表达式为( )
| A. | △H4=(△H1+△H2-3△H3)×$\frac{1}{3}$ | B. | △H4=(3△H3-△H1-△H2)×$\frac{2}{3}$ | ||
| C. | △H4=(△H1+△H2-3△H3)×$\frac{2}{3}$ | D. | △H4=(△H1-△H2-3△H3)×$\frac{3}{2}$ |
| A. | 常温常压下,等质量的N2和CO气休的原子数均为2NA | |
| B. | 在反应KC1O4+8HCI=KCl+4Cl2↑+4H2O中,每生成4molCl2转移的电子数为8NA | |
| C. | 含有3mol离子的过氧化钠固体和足量的水反应,电子转移数为NA | |
| D. | 标准状况下,80gSO3中含3NA个氧原子,体积约为22.4L |
| A. | 5、9、6 | B. | 4、9、6 | C. | 3、9、7 | D. | 5、9、10 |
| A. | 1 mol 硫酸钾中阴离子所带电荷数为NA | |
| B. | 将0.1mol氯化铁溶于1L水中,所得溶液含有0.1NAFe3+ | |
| C. | 乙烯和环丙烷(C3H6)组成的28g混合气体中含有3NA个氢原子 | |
| D. | 标准状况下,22.4L氯气与足量氢氧化钠溶液反应转移的电子数为NA |
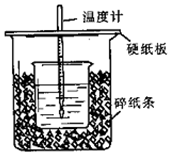 50 mL 0.50 mol•L-1盐酸与50 mL 0.55 mol•L-1NaOH溶液在图示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:
50 mL 0.50 mol•L-1盐酸与50 mL 0.55 mol•L-1NaOH溶液在图示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题: )的一条路线如图:
)的一条路线如图:
 .
. 、
、 .
.